碳酸锂广泛应用于陶瓷和医药等领域。已知β锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备Li2CO3的工艺流程如下: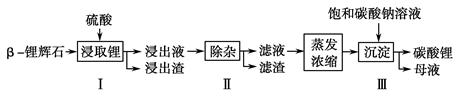
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是________________________________________
______________________________________________________________________________。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO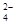 ,另含有Al3+、
,另含有Al3+、
Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有____________________________________________________________________________________。
(4)步骤Ⅲ中,生成沉淀的离子方程式为______________________________________________。
(5)从母液中可回收的主要物质是____________________________。
.(18分)A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略 去)
去)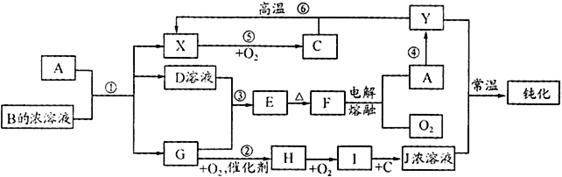
请填写下列空白:
(1)B的电子式为;
(2)D固体可用于净水,请用相应的离子方程式及简单文字说明原因:
;
(3)反应⑥的化学方程式为;
反应④在冶金工业上属于(填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为;
(5)反应②的化学方程式为;
反应③的离子方程式为;
(6)收集一试管H,将其倒置于水槽中,然后向试管中通入一定量的O2使试管内液面上升,最终剩余气体占试管容积的一半,则原有H与所通入O2的体积比为。
(8分)A、B、C、D四种物质之间有下图所示的转化关系。已知:A是一种非金属单质,为黄色晶体;B、C、D均为化合物;B是形成酸雨的主要成分之一。
请回答下列问题:
(1)化合物B是_______(填化学式,下同),化合物D是___________;
(2)B→C化学反应的类型是________反应(填“化合”、“分解”、“置换”或“复分解”)
(3)向D的稀溶液中滴加BaCl2溶液,能产生白色沉淀。写出该反应的离子方程式:
__________________________________________________。
(12分)下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题。
| 族 周期 |
ⅠA |
0 |
|||||||
| 1 |
H |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
① |
② |
F |
Ne |
|||||
| 3 |
③ |
Mg |
④ |
Si |
⑤ |
⑥ |
(1)②表示的元素是(填元素符号);
(2)①、⑤两种元素的原子半径大小为:① ⑤(填“<”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③ ④(填“<”或“>”);
(4)写出③与⑥两种元素所形成化合物的化学式__________。
(6分)氮气其化合物是中学化学的基础知识,请你回答下列含氮化合物的有关问题。
(1)汽车尾气中含有氮氧化物,严重污染大气。NO和NO2是常见的氮氧化物,这两种氮氧化物中,呈红棕色的是;
(2)一氧化氮在常温下很容易与空气中的氧气化合,生成二氧化氮。该反应的化
学方程式为:;
(3)实验室常用NH3做“喷泉实验”,该实验说明NH3的溶解性是溶于水(填“极易”或“极难”)。
能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢所是最理想的清洁能源之一。已知反应:2H2+O2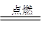 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为反应(填“吸热”或“放热”);
(2)当生成18gH2O时,H2O的物质的量是(填字母代号)。
A.1mol B.1mol/L C.1g/mol