某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。
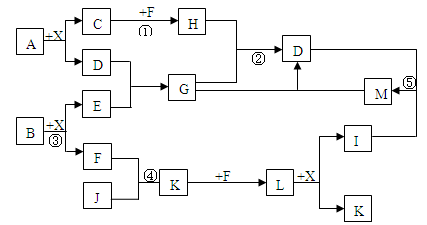
(1)写出化学式:A ,E ,L ;
(2)在反应①②③④⑤中属于氧化还原反应的是 ;
(3)反应③化学方程式为: ;
(4)写出下列离子方程式:反应② ;
G溶液与M溶液的反应 。
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)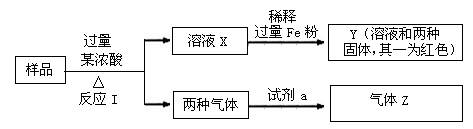
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)▲ 。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是▲ 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是▲ 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
▲ 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是▲ 。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)▲ 。
有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色。
③另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。
④另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:
(1)写出⑤所发生反应的离子方程式▲
(2)该溶液中肯定存在的阳离子是▲
(3)该溶液中肯定不存在的阴离子是▲
A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F。D、F的一个分子中只含有10个电子,常温下D是一种液体,E的相对分子量比D大。
(1)B的元素名称是,C单质的结构式是。
(2)A、B两元素还能形成一种比D相对分质量大16的化合物,请写出该化合物的一种用途;A、C两元素也还能形成一种比E相对分子大16的化合物,请写出实验室制备该化合物反应的化学方程式。
(3)E、F在一定条件下可以发生反应生成C元素的单质和D,该反应中氧化产物与还原产物的物质的量之比为。
(4)A、B、C三种元素能组成一种原子个数比为3:4:2的常见离子化合物,0.1mol·L-1的该化合物的水溶液中,溶液显 性(填“酸”、“碱”、“中”),用离子方程式解释原因 ,
该溶液中离子浓度由大到小的顺序是 。
A、B、C、D都是短周期元素,原子半径C> D >A>B。已知:A、B位于同一周期;A、D位于同一主族;D原子核内的质子数等于A、B原子核内的质子数之和;D原子最外电子层上的电子数是C原子最外电子层上的电子数的4倍。试回答:
(1)C和D元素分别是: C▲, D▲
(2)这四种元素中,在常温常压下的液体或气态氢化物的稳定性由大到小的顺序为▲
(3)A和B形成的三原子分子的电子式是▲, B与C形成的原子个数比为1 :1的化合物的电子式为▲,元素D的氧化物属于▲晶体。
(4) 写出以D的氧化物为原料工业制取单质D的化学方程式为▲
用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
⑴所需浓H2SO4的体积为。
⑵如果实验室有10mL、20mL、50mL量筒,应选用mL量筒,实验中还需要用到的仪器有烧杯、玻璃棒、、500mL容量瓶。
⑶若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容。
②定容时俯视刻度线。
⑷若定容时液面高于刻度线应采取的措施是。