(14分)X,Y,Z,Q,R是五种短周期元素,原子序数依次增大。X,Y两元素最高正价与最低负价代数和均为0;Q与X同主族;Z是地壳中含量最高的非金属元素,R的简单离子在同周期离子中半径最小。请回答下列问题:
(1)画出Z的原子结构示意图 ,工业上制取R单质的化学方程式为
(2)已知,由X,Y两种元素组成的相对分子质量最小的化合物W 3.2g在氧气中完全燃烧生成稳定化合物(常温常压下)放出178.06KJ的热量,写出W燃烧的热化学方程式
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系: (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为
②如果A,B均为由以上某些元素组成的盐,则A溶液显 性,原因是(用离子方程式表示) 。浓度均为0.1mol/L的A,B的溶液等体积混合,混合溶液中离子浓度由大到小的顺序为 。
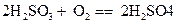 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H=" +67.7" kJ/mol
2N2H4(l)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7 kJ/mol
则肼完全燃烧的热化学方程式为______________________________________________。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,正极的电极反应式是______________________________________,电池工作一段时间后,电解质溶液的pH将_________(填“增大”、“减小”、“不变”)。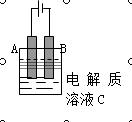
(3)上图是一个电化学装置示意图。用肼——空气 燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是AgNO3溶液, 若B极增重10.8 g,该燃料电池理论上消耗_____mol N2H4。
燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是AgNO3溶液, 若B极增重10.8 g,该燃料电池理论上消耗_____mol N2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示
肼的水溶液显碱性的原因_________________________________。
几种短周期元素的原子半径及其某些化合价见下表:
| 元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
| 常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于周期,族。
(2)A、H、J对应离子的半径由大到小的顺序是(填离子符号)_______________________________。
(3)A与I所形成的化合物的晶体类型是。
(4)DB2的电子式__________ 。
(5)D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式。
我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。根据你所学的知识,试回答下列问题:
(1)大气污染物二氧化硫溶于水生成亚硫酸,亚硫酸具有还原性,试写出雨水中亚硫酸被氧化为硫酸的化学方程式__________________________。
(2)某市是受酸雨影响比较严重的城市,电厂每年就要排放二氧化硫9.14万吨。目前该厂应用了国际上最成熟的石灰石-石膏湿法脱硫技术,使每年产生的二氧化硫成倍减少,“变”酸雨为石膏,达到了变废为宝的目的。请写出其中发生的反应中属于分解反应和化合反应的化学方程式各一个。
____________________________________________ 、 ____________________________________________。
(3)结合你所学的化学知识,你认为减少酸雨产生的途径还可采用的措施是___________________________________________________________。
核电荷数小于18的2种元素A、B,A原子最外层电子数为a ,次外层电子数为b;B元素原子M层电子数为a-b,L层电子数为a+b。则元素A是元素,B是元素。
(共5分)冶炼金属常用以下几种方法:①以C、CO或H2做还原剂②以活泼金属Na、Mg等还原③利用铝热反应原理还原④电解法⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
(1)Fe、Zn、Cu等中等活泼金属。
(2)Na、Mg、Al等活泼或较活泼金属。
(3)Hg、Ag等不活泼金属。
(4)V、Cr、Mn、W等高熔点金属。
(5)K、Rb、Cs、Ti等金属通常还原方法是。