I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)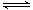 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示:
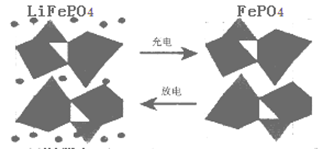
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D <E。其中A、B、C是同一周期的非金属元素,AC2为非极性分子。D单质与水形成的溶液具有漂白性。E的原子序数为24,ED3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)已知A、D形成的化合物分子空间构型为正四面体,而光气( )分子空间构型为平面三角形,说明原因。光气(
)分子空间构型为平面三角形,说明原因。光气(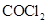 )分子中碳氧原子间的共价键的键型是(填序号)。
)分子中碳氧原子间的共价键的键型是(填序号)。
A.1个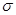 键B.2
键B.2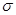 个键
个键
C.2个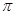 键D.1个
键D.1个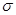 键,1个
键,1个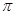 键
键
(3)写出等物质的量的D单质和SO2气体同时通入水中反应的离子方程式。
(4)ED3与B、C的氢化物形成的配合物的化学式为。
(12分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: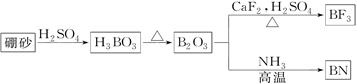
请回答下列问题:
(1)由B2O3制备BN的化学方程式是_____________________________________;
(2)B和N相比,电负性较大的是__________,BN中B元素的化合价为__________;
(3)在BF3分子中,F—B—F的键角是________, B原子的杂化轨道类型为________;
(4)BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________;
(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为_________,N原子L层的P电子比S电子多_________个。
(6)写出CaF2的电子式:________。
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。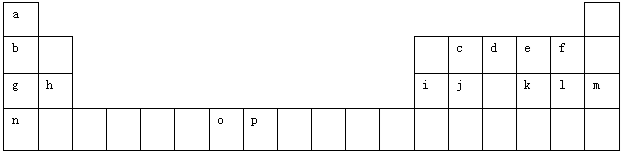
试回答下列问题:
(1)元素p的原子的电子占有种能量不同的原子轨道。
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为(用离子符号表示)。
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为______________,该分子是______(填“极性”或“非极性”)分子。
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____________。
(5)o、p两元素的部分电离能数据列于下表:
| 元素 |
o |
p |
|
| 电离能/kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____________________________________________________;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为,含有的化学键为。
(12分)下列是A、B、C、D、E五种短周期元素的某些性质:
| A |
B |
C |
D |
E |
G |
|
| 最低化合价 |
-4 |
-2 |
-1 |
-2 |
-1 |
—3 |
| 电负性 |
2.55 |
2.58 |
3.16 |
3.44 |
3.98 |
3.0 |
(1)A原子的核外电子排布的轨道表示式_______,C原子的价电子排布式________
(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是(写化学式)。
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是________(写化学式),
理由是________________________。
(4)A、B、D形成的氢化物沸点:________更高,热稳定性________更强(写化学式)。
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式________。
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为________。
(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa_______NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系______________。
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式________________
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)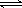 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=。
②该反应为反应(选填吸热、放热)。
③能判断该反应是否达到化学平衡状态的依据是。
(A)容器中压强不变(B)混合气体中 [CO]不变
(C)v正(H2)=v逆(H2O)(D)C(CO2)=C(CO)