2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
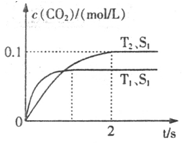
(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/xl0-4mol L-1 |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)/xl0-3mol L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
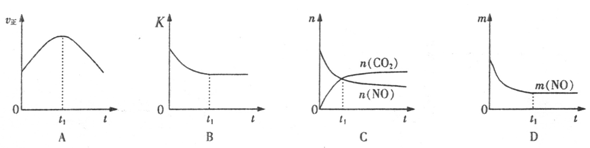
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0kJ • mol-1
2NO2 (g)  N2O4 (g) △H=-56.9kJ • mol-1
N2O4 (g) △H=-56.9kJ • mol-1
H2O(g) = H2O(l) △H=-44.0kJ • mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。
某学生为了探究足量的锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL,标况下) |
50 |
120 |
232 |
290 |
310 |
(1)假设用V1、V2、V3、V4、V5依次表示0~1、1~2、2~3、3~4、4~5每分钟内的反应速率,则速率由大到小的排列顺序为。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率V3=。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
以下甲、乙、丙为探究原电池原理的有关装置,试回答下列问题: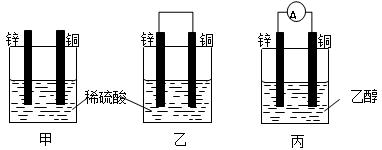
(1)甲中预计可以观察到得现象是:铜片上 (填“有”或“没有”)气泡产生,锌片上(填“有”或“没有”)气泡产生。
(2)乙中锌为原电池的极,电极反应是;铜为原电池的极,电极反应是。原电池总反应为
(3)丙中电流计A的指针是否发生偏转:(填“是”或“否”)
化学上常用一条短线来表示一对共用电子对,用元素符号和短线来表示物质结构的式子叫结构式,例如Cl2的结构式用Cl-Cl表示,H2O的结构式用H-O-H表示。
(1)写出下列物质的结构式:
①CO2②N2;③CH4;④C2H4。
(2)根据下列物质的结构式写出其相应的电子式:
①H―O―Cl_____;②H-O-O-H_______;
③ _____;④H-C≡C-H。
_____;④H-C≡C-H。
已知碳有两种常见的同位素126C、136C;氧有三种常见的同位素168O、178O、188O。
(1)由这五种微粒构成的CO的分子有种。
(2)本题中涉及种核素,种元素。
(3)一个相对分子质量最大的二氧化碳分子中有个电子,个中子;0.5 mol这种二氧化碳的质量是g。
金属钠是__________色金属,在空气中燃烧产物是__________,火焰呈__________色.将一块钠用小刀能切开,说明钠很__________,将切开的小块钠投入水中,发生反应的化学方程式为__________,现象是__________;在反应后的溶液中加入FeCl3溶液,反应的方程式为___________________________,反应的现象是_________________________.