(2014届湖南省益阳市高三下学期模拟考试理综化学试卷)
海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都来自于海水。
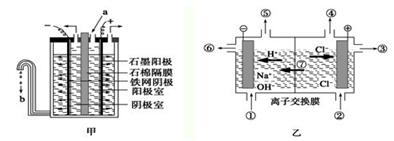
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式: 。
(2)图甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是 、 。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH g。
Ⅲ.下图是工业上生产镁的流程。
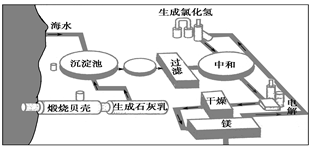
(1)写出下列反应的化学方程式:
①沉淀池: ②电 解:
(2)整个生产流程中循环使用的物质是 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项: 。
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO·Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是 。
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,产生H2的离子方程式是 。
(3)工业上以铝土矿(Al2O3·H2O)为原料生产铝,主要包括下列过程:
i.将粉粹、筛选后的铝土矿溶解在NaOH溶液中;
ii.加入过量的试剂A使所得溶液中析出Al(OH)3固体;
iii.使Al(OH)3脱水生成Al2O3;
iv.电解熔融Al2O3生成Al。
铝土矿粉粹的目的是 ,试剂A的化学式是 ,电解熔融Al2O3时,加入冰晶石,其作用是 。
(4)明矾化学式为KAl(SO4)2·12H2O,向明矾溶液中加入Ba(OH)2溶液,当溶液中的SO42-恰好沉淀时,铝元素的存在形式是 。
(5)美国普度大学研究开发出一种利用铝镓(化学式:AlGa)合金制取氢气的新工艺(如下图所示)。
i.写出常温下铝镓合金产生氢气的化学方程式 。
ii.下列有关该工艺的说法正确的是 。
| A.该过程中,能量的转化形式只有两种 |
| B.铝镓合金可以循环使用 |
| C.铝镓合金的熔点比金属铝低 |
| D.该工艺可利用太阳能分解水 |
氢气还原氧化铜反应不完全时,得到的是Cu、Cu2O、CuO的固体混合物。某化学兴趣小组为了探究某次氢气还原CuO实验最终所得的产物的组成,进行了如下实验:
①取一定质量的均匀的上述固体混合物A,将其分成两等份。
②取其中一份用足量的氢气还原,测得反应后固体的质量减小了3.20g
③另一份加入500mL的稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,所含氧元素的物质的量为_________。
(2)A中,n(Cu)+n(Cu2O)=_______________。
(3)所用稀硝酸的物质的量浓度为_______________。
某芳香族化合物A分子式为C8H10O2 为测定其结构做如下分析:
(1)为确定羟基的个数, 将1mol A与足量钠反应生成氢气22.4L(标准状况下),说明A分子中含羟基______个。
(2)核磁共振氢谱显示A有3个峰,峰面积之比为1:2:2,该物质的结构简式为________________。
(3)A在Cu催化下可被氧气氧化生成有机物B,B的相对分子质量比A小4。试写出反应的方程式____________________。
(4)0.25mol B与足量银氨溶液充分反应生成有机物C,同时得到银______克。将生成的有机物C酸化后得到有机物D。已知A、D在一定条件下可缩聚生成高分子化合物E。写出E在足量NaOH溶液中水解的化学反应方程式___________________。
(5)有机物F是有机物B的一种同分异构体。F能使氯化铁溶液显紫色,含有4种氢原子。试写出F的结构简式_____________________(只写出一种即可)。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H__________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,平均反应速率v(NO2)为__________mol·L-1·s-1,反应的平衡常数K为_____________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___________100℃(填“>”或“<”)。
(3)100℃时达到平衡后, 继续往容器中通入0.1N2O4 mol,则化学平衡_________(填“左移”、“右移”或“不移动”),达到新平衡时N2O4 的浓度________0.04mol/L。
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为_______。
(2)操作Ⅰ是_________、冷却结晶________、洗涤、干燥。。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因___________________________。
(4)加入Sn粉的作用有两个:①调节溶液pH,②__________________________。
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是___________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是___________________。