下列叙述中,正确的是
| A.糖类化合物都具有相同的官能团 |
| B.乙醇和汽油都是可再生能源,所以要大力发展“乙醇汽油” |
| C.蛋白质的水解产物都含有羧基和羟基 |
| D.油脂的种类很多,但它们水解后都一定有一产物相同 |
下列物质属于碱性氧化物的是
| A.NaOH | B.O2 | C.CaO | D.SO2 |
对于元素周期表和元素周期律的发现有突出贡献的科学家是
| A.拉瓦锡 | B.阿伏加德罗 |
| C.门捷列夫 | D.道尔顿 |
下列关于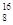 O的叙述正确的是
O的叙述正确的是
| A.质量数为8 | B.质子数为8 |
| C.中子数为16 | D.电子数为16 |
下列各组离子在水溶液中能大量共存的是
| A.Na+、NH4+、HCO3-、OH- | B.Cu2+、Fe3+、Cl-、NO3- |
| C.H+、Fe2+、Cl-、NO3- | D.H+、A13+、Cl-、SO42- |
设NA为阿伏加德罗常数,下列说法正确的是:
| A.NA的精确值为6.20×1023 mol-1 |
| B.18克水所含氢原子数为2NA |
| C.4.48L氧气所含分子数0.2 NA |
| D.2.4 g镁变成Mg2+时,失去电子数目为0.2 NA |