下列叙述正确的是( )
| A.1.00 mol NaCl中含有6.02×1023个NaCl分子 |
| B.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| C.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| D.电解58.5 g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
设NA表示阿伏加德罗常数,下列说法正确的是
| A.在含有NA个CH3COO-的醋酸溶液中, H+ 数目略大于NA |
| B.N60结构如右图,28gN60单质中含有的N-N键个数为NA |
| C.2.9g 熟石膏(2 CaSO4·H2O)含有的结晶水分子数为0.02NA |
| D.在标准状况下,2.24L的CCl4中含有C—Cl键的数目约为0.4NA |
NA代表阿伏加德罗常数。下列说法中,不正确的是
| A.标准状况下,NO和 O2各11.2 L混合,所得混合气体的分子总数为 0.75 NA |
| B.25℃时,l L pH=13的Ba(OH)2溶液中含有OH―的数目为0.1 NA |
| C.1 mol C30H62分子中含有共价键的数目为 91 NA |
| D.2.8g乙烯与丙烯的混合物中含碳原子的数目为 0.2NA |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,1L液态水中含有的H+ 数目10-7NA |
| B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA |
| C.常温下,pH=3的醋酸溶液中,醋酸分子的数目一定大于0.001NA |
| D.1mol碳烯(:CH2)中含有电子数为8NA |
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为_______________________________________。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为______________________________;
该方法的优点是____________________________________。
(3)一定温度下,1 mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p(NH3)×p(H2S) = a(Pa2),则容器中的总压为_____________Pa;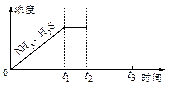
②如图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
下列叙述正确的是
| A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |