(2014届浙江省杭州市杭州学军中学高三第二次月考化学试卷)
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取适量漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝,后褪色 |
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I- + 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
写出途径II的化学反应方程式: 。
若将Cu改为Zn,发现除得到SO2外还有得到一种气体,该气体可能为 。写出生成该气体的离子方程式 。
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。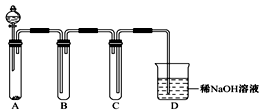
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。:
B的作用为: ;
C的作用为: ;
如要得到较为纯净的氯气可怎么改进该装置: 。
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。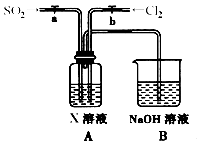
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若要证明SO2的漂白性,X为 ,操作为 ,现象为 。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为: ,原因是 。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为 ,与②现象不同的原因是 (书写相应的化学方程式)。
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下:
(1)方案中试剂M是 ;沉淀A是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。若沉淀B、C的质量均不为零,则生成B的离子方程式为: 。
(4)乙同学对甲同学的方案做了如下改进:
沉淀D为 ,与甲同学的方案相比,此方案的优点 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
A.酸性 B.中性
C.碱性 D.可能酸性,也可能碱性
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是_ _。反应中需不断搅拌,目的是___________________。
(2)仪器A的名称是________,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:
其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
| A.冷凝管 |
| B.酒精灯 |
| C.温度计 |
| D.分液漏斗 |
E.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
(15分)三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到。
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解。实验室制取PCl3的装置示意图和有关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 白磷 |
44.1 |
280.5 |
1.82 |
| PCl3 |
-112 |
75.5 |
1.574 |
| POCl3 |
2 |
105.3 |
1.675 |
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,反应离子方程式为 ,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有 。
(2)实验过程中有以下操作:①加入白磷②打开K2③打开K1④加热,正确的操作顺序为: ,通入CO2的目的是 。E烧杯中加入冷水的目的是 ,干燥管中碱石灰的作用是
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷除去PCl5和过量白磷后,再除去PCl3中的POCl3可用 的方法有制备纯净的PCl3。
(5)①已知亚磷酸(H3PO3)是二元弱酸,PCl3与足量的NaOH溶液反应可生成两种正盐写出反应的化学方程式为 。
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
I.硝酸铜在1000℃时分解:Cu(NO3)2 Cu+2NO2↑+O2↑,用试管收集一试管气体并倒立于盛水的水槽中,写出气体溶解的化学反应方程式 ,并判断液体 (填“能”“不能”)充满整个试管(假定倒吸进试管的液体不流出)。
Cu+2NO2↑+O2↑,用试管收集一试管气体并倒立于盛水的水槽中,写出气体溶解的化学反应方程式 ,并判断液体 (填“能”“不能”)充满整个试管(假定倒吸进试管的液体不流出)。
II.工业上生产硝酸铜晶体的流程图如下:
①在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围.
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
②蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是 (结合离子方程式说明)。
③如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。
a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30℃时,可以析出Cu(NO3)2·3H2O晶体
④某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:2H2O OH—+H3O+,则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,则同时生成的另一种物质为 。
OH—+H3O+,则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,则同时生成的另一种物质为 。