(2014届江苏省南京市、淮安市高三第二次模拟考试化学试卷)
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
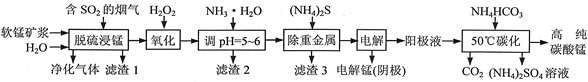
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为 。
(2)“滤渣2”中主要成分的化学式为 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 。
(4)“电解”时用惰性电极,阳极的电极反应式为 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3; ; 。
某化合物的化学式为(NH4)2Fe(SO4)2,它在水溶液里电离时生成两种阳离子和一种酸根离子。
(1)写出(NH4)2Fe(SO4)2的电离方程式 。
(2)该化合物中氮元素与铁元素的质量比为 。
(3)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成(用离子符号表示) 。
(4)若向该溶液中加入过量的氨水,只能发生一个离子反应,则该反应的离子方程式为 。
下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2的过程。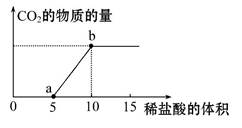
(1)写出a点以前发生反应的化学方程式:
。
(2)写出a到b点发生反应的化学方程式:
。
(3)若某Na2CO3溶液中含mmol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HC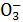 的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于 mol(用含字母m的代数式表示)。
的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于 mol(用含字母m的代数式表示)。
已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。
(1)写出下列物质的化学式:A 、D 、F 。
(2)A、B、C、D四种物质分别长期暴露在空气中,其最终产物为 ,其中变质过程中有氧化还原反应发生的物质是(填写物质对应的化学式)
_________________________________________________________________。
(3)将C加入CuSO4溶液中,发生反应的化学方程式为 。
X、Y、Z、W四种化合物均由1~20号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答:
(1)写出下列物质的化学式:X ;Y ;W 。
(2)X与Y在溶液中反应的化学方程式是
;
X→Z的化学方程式为
;
X的热稳定性 (填“大于”“小于”或“等于”)Z。
金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融) 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是 。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是 。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式 ,生成物的颜色为 。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为 ,检验该反应产生的气体的方法是 。