(2014届东北三省四市高三第一次模拟考试理综化学试卷)
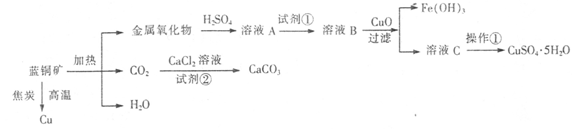
蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下:
已知:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
|
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式
。
(2)从下列所给试剂中选择:实验步骤中试剂①为 (填代号)。
a.KMnO4 b.K2Cr2O7 c.H2O2 d.氯水
(3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至 时停止加热。
(5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是
(填代号);
a.氨水 b.盐酸 c.水蒸气 d.NaOH溶液
如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因 。
(6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为 。
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是,配位数为。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是和。
②T元素最可能是(填“s”“P” “d”或“ds”等)区元素,位于族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为,其中心原子的杂化方式为。
自来水生产的流程示意图见下: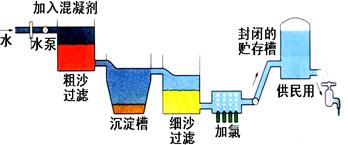
⑴ 混凝剂除去悬浮物质的过程(填写序号)
①只是物理变化②只是化学变化③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成沉淀。
⑵ 实验室过滤操作所用到的玻璃仪器是。
⑶ 我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒,请写出有关的化学反应方程式。
下列物质中,可以作为氯气的代用品。(填写序号)
①臭氧②NH3(液)③K2FeO4④SO2
⑷ 有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有离子交换树脂和离子交换树脂的离子交换柱。(填“阴”或“阳”)
⑸ 测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
求水中的溶解氧量(以mg·g-1为单位)
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示: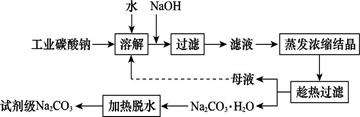
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: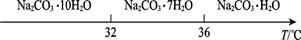
Ⅱ.有关物质的溶度积如下
| 物质 |
CaCO3 |
MgCO3 |
Ca(0H)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=。
(2)“母液”中除了含有Na+、CO32—外,还含有等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行:(填“可行”或“不可行”),并说明理由:。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g)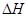 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)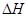 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:。
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图的转化关系,已知C为密度最小的气体,甲为非电解质。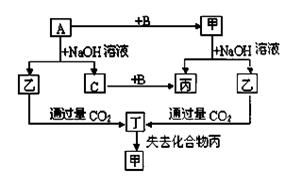
根据以上转化关系回答下列问题:
(1)写出下列物质的化学式:A B丁。
(2)元素A在周期表中的位置是,写出甲的一种用途。
(3)写出下列变化的方程式:
A与NaOH溶液反应的化学方程式
乙与过量CO2反应的离子方程式
A、B均为重要的有机化工原料。
已知: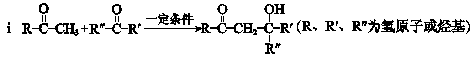
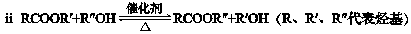
请回答下列问题:
(1)A分子内含有苯环,其名称是。
(2)B分子中只有一种氢原子,2 mol B反应生成1 mol C的化学方程式是:
。
(3)B的一种同分异构体能发生银镜反应,该反应的化学方程式是:
。
(4)D分子内有3个甲基,其结构简式是。
(5)F的结构简式是。F和L反应生成G是加成反应,L的结构简式。
(6)A与B反应生成J的化学方程式是。
(7)K分子内含有六元环,可发生水解反应,其结构简式是。