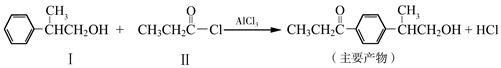
已知反应①:
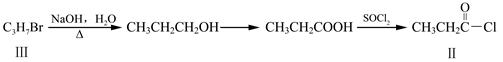
化合物Ⅱ可由化合物Ⅲ合成:
(1)化合物Ⅰ的分子式为 。反应①的反应类型为 。
(2)过量的化合物Ⅰ与HOOCCH2CH2COOH发生酯化反应,反应的化学方程式为 (注明条件)。
(3)化合物Ⅲ的结构简式为 。化合物Ⅲ可与NaOH乙醇溶液共热,反应的化学方程式 。
(4)化合物Ⅰ在一定条件下氧化生成化合物Ⅳ(分子式为C9H10O),化合物Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为2:2:1,Ⅴ的结构简式为 。
(5)一定条件下,1分子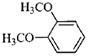 与1分子
与1分子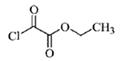 也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)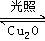 2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:
则1mol N﹣H键断裂吸收的能量约等于 。
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是 。
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH)  2Ni(OH)2。请由总反应式回答:
2Ni(OH)2。请由总反应式回答:
1.电解质溶液应该是 (选填酸溶液、碱溶液),
②.电池放电时,负极反应式为 ,
3.外电路中每通过0.2NA个电子时,H2的质量理论上减小 g,
4.电池工作时,电子由 极通过外电路流向 极(选填正、负)。
(1)下列物质中能导电的是 ,属于强电解质的是 ,
①H2SO4,②熔融硫酸钠,③ NH3•H2O,④ CO2,⑤碳酸钙,⑥ CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2 mol/LNaOH溶液充分混合。经判断:(选填有或无)沉淀生成,依据是 (已知此温度下KSP[Mg(OH) 2]=1.8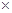 10
10 )
)
(3)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=或“<”),原因是 (用恰当的化学用语和必要的文字说明回答)。
研究发现,含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(1)雾霾中能形成酸雨的物质是_____________。
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
N2(g)+O2(g) 2NO(g) △H =" +180.50" kJ·mol-1
2NO(g) △H =" +180.50" kJ·mol-1
①下列表示NH3(g)与NO(g)在一定条件下反应,生成无污染气体的能量转化关系示意图正确的是:___________(填字母)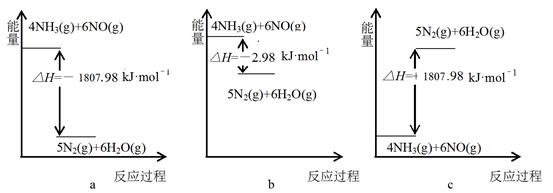
② 右图是反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。
5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。
(3)右图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,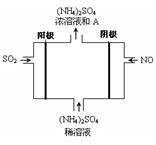
① 阴极的电极反应式是 。
② 物质A是_____________(填化学式),理由是_________________________。
(4)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,请解释:
① 随空/燃比增大,CO和CxHy的含量减少的原因是 。
② 当空/燃比达到15后,NOx减少的原因可能是_____________。
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl是白色固体,难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以硫化铜精矿为原料生产CuCl的工艺过程如下:
回答下列问题:
(1)CuS精矿经250 ℃低温焙烧后生成CuO,步骤②中主要反应的离子方程式是 。
(2)步骤③先加NaCl、通入SO2时无沉淀,加水稀释就产生大量白色沉淀,其原因是 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_______(写名称);步骤⑥醇洗的作用是 。
(4)已知25℃,101 kPa时:S(s)+O2(g)==SO2(g) ∆H=-296.8 kJ/mol
2Cu(s)+O2(g)==2CuO(s)∆H=-314.6 kJ/mol
Cu(s)+S(s)==CuS(s)∆H=-53.1 kJ/mol
步骤①中CuS与O2反应的热化学方程式是 。
(5)CuS晶胞结构如图所示,其中含有硫原子的数目是 。
(6)假设上述①~③步反应完全转化,④~⑦步操作共损失产品3.5%,反应生成的硫酸全部被循环利用,则生产100 kg 96.5%的CuCl(Mr=99.0)产品,除循环利用之外,需要处理的尾气中含SO2 m3(标准状况)。
(利多卡因是医用临床常用的局部麻药,其一种合成路线如下:
已知:Ⅰ.R OH
OH R
R Cl Ⅱ.
Cl Ⅱ.
请回答下列问题:
(1)A分子中碳原子的杂化轨道类型有 ,D的名称为 。
(2)C的结构简式为 ,⑥的反应类型是 。
(3)反应③的化学方程式为 。
(4)写出G与NaOH溶液在加热条件下反应的化学方程式: 。
(5)E存在多种同分异构体,写出满足下列条件的所有同分异构体的结构简式: 。
a.能使Br2的CCl4溶液褪色,遇FeCl3溶液显色 b.含有-NH2,苯环上只有1种氢