(14分)实验室获取氮气有很多种途径,常见的有3种方法。
方法一:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L。 进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)。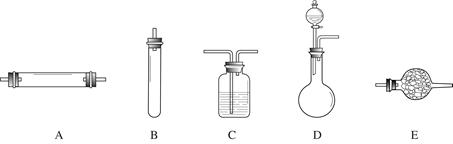
为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置 (选填装置编号)中加入 (填名称)以除去其它杂质气体。
方法三:将亚硝酸钠(NaNO2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气。下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题。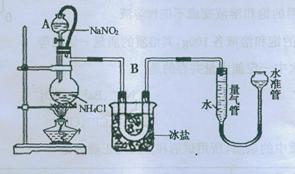
【查阅资料】
(1)NaNO2+NH4Cl NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
(此反应会放出大量的热);
(2)B部分中冰盐是冷凝作用
【实验探究】
① ;
②20℃时,取含溶质0.21g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】
(1)加入药品前必须进行的实验①是 ;
(2)步骤④中,移走酒精灯的目的是 ;
(3)计算生成氮气的质量和密度。 (4分,计算过程中以及最终数据均保留2位小数)
【解释与结论】
1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大)
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
C
防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气
C.使NaNO2饱和溶液顺利滴下 D.防止溶液冲入U形管
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 .
A.严谨求实的科学态度和敢于怀疑的批判精神
B.科学研究中遇到疑惑就趁早放弃,不要浪费时间
C.不能因为微小的差异而放过一次成功的机会
D.要相信权威,权威一定是正确的
英国科学家法拉第在《蜡烛的故事》系列讲座中,对蜡烛燃烧所涉及的知识进行了全面介绍.生产蜡烛的主要原料是石蜡和少量的硬脂酸添加剂等有机物,现在让我们一起对蜡烛原料的组成元素进行探究.
(1)写出C不完全燃烧的化学方程式:.
[提出问题]生产蜡烛的原料中主要有哪些元素?
[假设与猜想]主要原料为有机物,猜想:
(2)①一定有元素;②可能还有氢元素和氧元素.
[实验设计]据上述三种元素的猜想制订实验方案.
实验一:如图1所示,在蜡烛火焰上方放置一块洁净、干燥的玻璃片,一会儿观察到玻璃片上生成一些细小的水珠.
实验二;如图2所示,在蜡烛火焰上方罩一个内壁附着有澄清石灰水的烧杯,观察现象.
[证据与结论](3)实验一,观察到玻璃片上有细小水珠时,说明原料中一定存在(填元素符号).实验二,观察到烧杯内壁附着的,则猜想①成立.
[分析与交流](4)实验一和实验二获得的证据均不能证明原料中一定存在 元素,因为.
(5)写出C的两条化学性质.
某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气.根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐.
[猜想与假设]
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解.
乙同学:铁钉里的加快了H2O2的溶液分解.
[设计方案和实验] 完成下列表格
| 实验方案 |
实验现象 |
结论 |
| 方案一:向盛有10mL 5% H2O2溶液的试管中 加入2g氧化铁粉末,将一根带火星的木条放 在试管口,观察现象. |
甲同学结论成立. |
|
| 方案二:向盛有10mL 5% H2O2溶液的试管中加入粉末,将一根带火星的木条放在试管口,观察现象. |
乙同学结论. (填“成立”或“不成立”) |
[讨论交流] 丙同学认为“方案一”只能说明Fe2O3加快了H2O2溶液的分解,并不能说Fe2O3就一定是催化剂.你是否支持丙同学的观点?,如果要证明氧化铁是催化剂,就要设计一个实验来证明,这个实验的设计原理是.
(提示:下面小题若答对将奖励4分,但化学总分不超过60分.)
[反思与评价] 丁同学仔细观察“方案二”中一直没有现象的试管,过了一段时间后发现试管中也产生了气体,丁同学对此现象进行深入思考和分析,得出可能的原因,你能想出其中的原因吗?。
安徽凤阳盛产石灰石.石灰石的主要成分是碳酸钙,某节课上同学们对碳酸钙高温加热一段时间剩余固体的成分进行了探究.
[提出问题]剩余固体成分是什么?
[猜想与假设]
A、全部是碳酸钙
B、
C、碳酸钙和氧化钙的混合物
[设计并完成实验]请填写(1)中结论和(2)中的实验步骤及实验现象
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液. |
溶液变红 |
剩余固体成分中一定含有 .(填化学式) |
| (2) |
剩余固体成分中 一定含有碳酸钙. |
[实验结论]通过以上实验得出,原A、B、C三个假设中,假设(填字母)成立.
[讨论交流]有同学提出证明实验(1)的结论可用“取少量固体于试管中,加适量水振荡,直接通入CO2,看溶液是否变浑浊”的方案也行.你是否赞成他的观点,.
某化学兴趣小组探究常温下碳酸钠饱和溶液的酸碱度.
【猜想与假设】溶液的pH可能是(填入你的猜想与假设):
①pH>7;②pH;③pH.
[设计与实验]小方、小钟、小陈三位同学进行了如下实验:
小方:取pH试纸于玻璃片上,用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7.
小钟:取pH试纸于玻璃片上,先用蒸馏水润湿pH试纸,然后用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7.
小陈:取pH试直接浸入碳酸钠溶液中,测得pH>7.
【评价】以上三位同学中操作规范的是同学,其余两位同学操作上的错误是;.
【结论】从物质的类别看,碳酸钠是一种(填“酸”或“碱”或“盐”),它的溶液显碱性,说明显碱性的溶液(填“一定”或“不一定”)是碱的溶液.
【应用】根据碳酸钠溶液显碱性,说出它在日常生活中的一种用途:.
实验课上,小舟同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”并用实验加以验证
(1)他做了如下实验
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 |
无色酚酞试液变红 |
无色溶液中含有氢氧化钠 |
小玉认为小舟的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是:
(2)小玉设计了另一个实验:
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量样品于试管中,加入 ②过滤,向滤液中滴加几滴硫酸铜溶液 |
③ ④ |
无色溶液中确实含有氢氧化钠 |
(3)小玉的实验可靠性高的原因是①.②.