有机物G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。其中A是一种相对分子质量为70的烃,核磁共振氢谱有四个峰且峰面积之比为6:2:1:1;B是一种芳香族含氧衍生物,相对分子质量在100-130之间,B中含氧元素的质量分数为13.1%,F可以使溴的四氯化碳溶液褪色。
已知:

请回答下面的问题:
(1)化合物A的结构简式为____,按系统命名法命名的名称是____。
(2)化合物B的分子式为____,B在上图转化中发生��反应所属的反应类型是____。
(3)写出D→E反应的化学方程式____。
(4)写出C与E生成G反应的化学方程式____。
(5)E的同分异构体有多种,写出符合下列条件的所有物质的结构简式____。
a.属于芳香族化合物且苯环上的一氯代物有两种;b.含有“ ”基团
”基团
(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Cu(OH)2 |
5.6 |
6.7 |
| Al(OH)3 |
3.8 |
4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是:。
(2)操作Ⅰ为调节溶液的PH值,范围为,加入的物质X可以是()
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式:。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是:。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为:。
CuOH + H+的平衡常数为:。
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。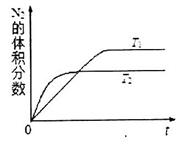
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。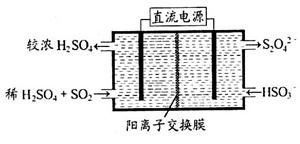
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L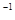 的醋酸与b mol
的醋酸与b mol L
L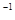 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。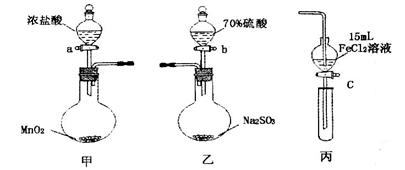
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下: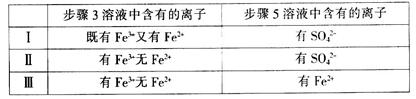
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
.(本题16分)已知醛或酮可以发生如下反应: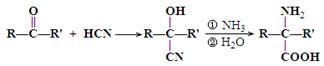
苯丙氨酸( )是合成APM的原料之一。APM的结构简式如图所示。
)是合成APM的原料之一。APM的结构简式如图所示。
(1)指出APM的结构中含氧官能团的名称__________
(2)下列关于APM的说法中,正确的是 _。
A属于糖类化合物 B分子式为C14H18N2O5
C既能与酸反应,又能与碱反应
D能发生酯化反应,但不能发生加成反应
E1 molAPM与NaOH反应最终生成1mol H2O
(3)APM在酸性环境水解的产物中,相对分子质量为133的有机物与氨基乙酸(H2N-CH2COOH)以1:1发生缩合反应形成一个含有六元环的化合物。该环状化合物的结构简式为。
(4)苯丙氨酸的一种合成途径如下图所示: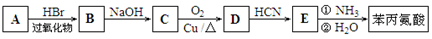
①烃 A的结构简式为。1 molD完全燃烧消耗O2_______mol.
② 写出C → D反应的化学方程式:.
③ 某苯的同系物苯环上的一硝基取代物只有一种,该硝基取代物W是苯丙氨酸的同分异构体。W的结构简式为。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是。
③中X试剂为 。
(3)④的离子方程式为。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有和。