下列有关化学用语表示正确的是
A 二氧化硅的分子式:SiO2
B质子数为53,中子数为78的碘原子: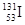
C甲基的电子式: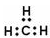
D邻羟基苯甲酸的结构简式: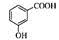
标准状况下,m1g气体A与m2g气体B的分子数相等,下列说法中正确的是()
A.1个A分子的质量是1个B分子的质量的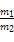 倍 倍 |
B.同温同体积的A与B的质量比为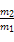 |
C.同温同质量的A与B的分子数比为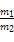 |
D.同温同压下A与B的密度比为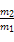 |
用NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.在1 L 0.1 mol/L硫化钠溶液中阴离子总数大于0.1NA |
| B.1 mol O2作氧化剂时转移电子数一定为4NA |
| C.标准状况下,22.4 L戊烷所含分子数为NA |
| D.在1 L 1.0 mol/L NaCl溶液中含有NA个NaCl分子 |
NA表示阿伏加德罗常数的值,下列叙述正确的是()
| A.标准状况下,11.2 L四氯化碳中C—Cl键的数目为2.0NA |
| B.常温下,1 L 0.1 mol/L NH4NO3溶液中的氮原子数为0.2NA |
C.在反应:H2O2+Cl2 2HCl+O2中,每生成32 g氧气,转移的电子数 2HCl+O2中,每生成32 g氧气,转移的电子数为4NA |
| D.22.4 L由CO和C2H4组成的混合气体的质量一定为28 g |
设NA为阿伏加德罗常数的值。下列说法正确的是()
| A.常温常压下,17 g甲基(—14CH3)所含的中子数为9NA |
| B.pH=1的稀硫酸中含有的H+数为0.1NA |
| C.7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| D.3 mol NO2和足量H2O反应,转移NA个电子 |
下列说法正确的是
| A.2.24 L CO2中共有的原子数为0.3×6.02×1023 |
B.1.8 g N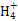 共有的质子数为6.02×1023 共有的质子数为6.02×1023 |
| C.1 mol重水分子所含中子数为10×6.02×1023 |
| D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023 |