工业上使用“渗铬(Cr)技术”可提高钢铁制品的抗腐蚀能力。其中一个主要反应的化学方程式:Fe + CrCl2 =" Cr" + FeCl2。已知参加反应铁的质量为112 kg,计算生成铬的质量。
张玉同学在实验室发现了一瓶敞口放置的过氧化氢溶液,他认为该溶液中溶质质量分数减小了,需要重新测定溶质的质量分数并更换试剂瓶的标签,他做了如下实验:称量该溶液34.0g倒入烧杯中,然后向其中加入少量二氧化锰,至不再放出气体后,再称量烧杯中混合物的质量,称量结果是33.7g.
(1)该溶液溶质质量分数减小的理由是________________.
(2)若二氧化锰的质量为0.5g,则生成气体的质量为________g.
(3)依据(2)中条件,计算该瓶溶液中溶质的质量分数.
黄铜是一种重要的金属材料,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
| 样品 |
第1份 |
第2份 |
第3份 |
第4份 |
第5份 |
| 取样品质量/g |
40.0 |
40.0 |
40.0 |
40.0 |
40.0 |
| 取稀硫酸质量/g |
30.0 |
60.0 |
90.0 |
120.0 |
150.0 |
| 产生气体质量/g |
0.3 |
0.6 |
0.9 |
1.0 |
1.0 |
按要求回答下列问题:
(1)根据实验数据分析,从第________份开始,金属已经反应完全了.
(2)列式计算该黄铜样品中金属锌的质量分数.(要求写出计算过程)
(3)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线.
有关食品添加剂与食品安全问题,引起了人们的广泛关注.其实,食品添加剂是指用于改善食品口味、延长食品保存期甚至增加食品营养成分的一类天然或化学合成物质,但如果被过度使用,则会危害人的健康.为了食品安全,国家对食品添加剂的使用有严格控制.
(1)食盐也是一种食品添加剂,其中的Na+既可增加食物的咸味,又是人体必需的无机盐.但卫生机构建议,人体每天钠元素的摄入量不宜超过2.3g.如果人体所需的钠元素全部来自食盐,那么,一个人每天食盐的摄入量不宜超过________g.
(2)饮料中的咖啡因有提神作用,但摄入量不宜过多.世界卫生组织建议青少年每天咖啡因的摄入量不能超过85mg.某种体积250mL的罐装饮料,含咖啡因的质量分数为0.02%.若某同学一天喝了2罐这种饮料,则他摄入的咖啡因有________mg.(该饮料密度约为1g/mL)
(3)了解了有关食品添加剂知识后,当你在选购食品时应该________.(可多选)
| A.选择加工度低的食品,以免摄入过多的添加剂 |
| B.尽量选择色、香、味俱全的食品,以保证口味 |
| C.多关注食品营养表中添加剂的品种和用量 |
| D.只关注食品的营养成分,不在乎是否含有添加剂 |
富含淀粉的谷物、甘薯等可以酿酒.在酿酒过程中淀粉在酶的作用下转化为葡萄糖,葡萄糖发酵为酒精.香甜的酒酿就是利用该原理,用酒曲酶(俗称酒药)制作的.家庭一般制作酒酿的简单流程图如下(注:有机反应化学方程式可用箭号表示):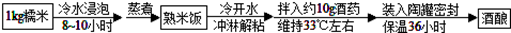
(1)配平化学方程式:(C6H10O5)n(淀粉)+________H2O nC6H12O6(葡萄糖).
nC6H12O6(葡萄糖).
(2)如温度、水分等因素控制不当,易导致乳酸量过多而味偏酸,请完成该反应的化学方程式:C6H12O4(葡萄糖) 2________(乳酸).
2________(乳酸).
(3)成熟的酒酿放置时间越长酒味越浓,因为更多的葡萄糖在酒化酶作用下发酵分解为酒精(C2H5OH)和二氧化碳,写出该反应的化学方程式:________________________________________________.
(4)若用1kg大米酿米酒,假设其中有0.81kg的淀粉全部转化为酒精,则理论上可酿制含酒精质量分数为10%的米酒________kg.
[提示]由淀粉转化为酒精的关系式为(C6H10O5)n~2nC2H5OH.
某同学欲测定草木灰中碳酸钾的含量,称取69g试样于烧杯中,加入29.2g稀盐酸恰好完全反应,反应后,称得混合物的总质量为93.8g(忽略二氧化碳的溶解对质量的影响).请计算:
(1)反应过程中产生的二氧化碳质量为________g.
(2)该草木灰试样中碳酸钾的质量分数.