工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: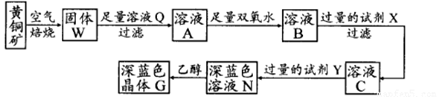
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: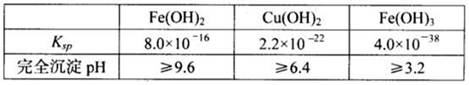
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式 ;
(2)试剂X的化学式为 ,双氧水的作用是 ;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH值的方法是 ;
(4)在溶液N中加入乙醇的目的是 。
实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g· cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-l30 |
9 |
-1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式:。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞。请写出发生堵塞时瓶B中的现象:。
(3)在装置C中应加入(填字母),其目的是_________________
a.水b.浓硫酸c.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用洗涤除去。(填字母)
a.水b.氢氧化钠溶液c.碘化钠溶液 d.乙醇
(5)若产物中有少量副产物乙醚,可用的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是。
工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下: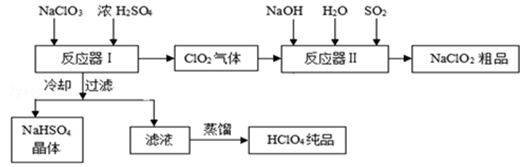
已知:
NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃.
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为,冷却的目的是,能用蒸馏法分离出高氯酸的原因是.
(2)反应器Ⅱ中发生反应的离子方程式为.
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是.
(4)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有请写出工业上用氯气和NaOH溶液生产另一种消毒剂NaClO的离子方程式.
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图1:
(1)实验室焙烧海带,需要下列仪器中的(填序号).
a.试管
b.烧杯
c.坩埚
d.泥三角
e.铁三脚架
f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①,③.
(3)提取碘的过程中,可选择的有机试剂是.
| A.甲苯、酒精 | B.四氯化碳、苯 |
| C.汽油 、乙酸 | D.汽油、甘油 |
(4)③过程需要使用的主要玻璃仪器为.
(5)小组用CCl4萃取碘水中的碘,在如图2的分液漏斗中,下层液体呈色;他们打开分液漏斗活塞,却未见液体流下,原因可能是.
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图3中的错误之处:
①;②;③.
(7)进行上述蒸馏操作时,使用水浴加热的原因是.
(12分)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+ Br2 + H2O→C6H12O7(葡萄糖酸)+ 2HBr
2C6H12O7(葡萄糖酸)+ CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+ H2O + CO2↑
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水、易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下:
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是:________。 制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是_______。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是_______。
A.新制Cu(OH)2悬浊液B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH 溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是;本实验中不宜用CaCl2替代CaCO3,理由是。
(3)第③步需趁热过滤,其原因是。
(4)第④步加入乙醇的作用是。
(5)第⑥步中,下列洗涤剂最合适的是。
A.冷水B.热水C.乙醇D.乙醇-水混合溶液
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)图1中仪器A的名称是。甲同学实验步骤:连接仪器、、加药品、滴入试剂。
(2)①图1中烧瓶B中的盛放试剂为碳酸钙,C中盛放试剂为硅酸钠溶液,则甲同学设计实验的依据是。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是。
(3)图2中A处反应的离子方程式。
(4)乙同学发现图2中B处试纸变蓝,C处红纸褪色,据此(填“能”或“不能”)得出溴的非金属性强于碘,理由是。