工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下: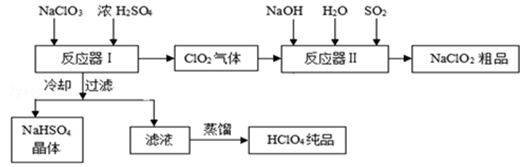
已知:
NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃.
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 .
(2)反应器Ⅱ中发生反应的离子方程式为 .
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 .
(4)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 请写出工业上用氯气和NaOH溶液生产另一种消毒剂NaClO的离子方程式 .
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯。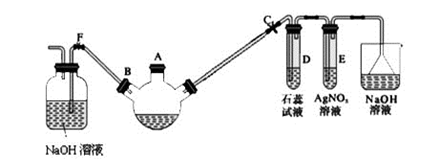
请分析后回答下列问题
(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为。
(2)D中出现的现象为。
(3)E中发生反应的离子方程式为。
(4)三颈烧瓶右侧导管特别长,除导气外还起的作用是。
(5)待三颈烧瓶中的反应进行到最后但仍有气泡冒出时松开F夹,关闭C夹,可以看到的现象是。
(6)反应结束后将三颈烧瓶中的溴苯分离出来的实验方法是(铁屑已分离)。
(12分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为:
2NH3+3CuO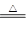 N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题: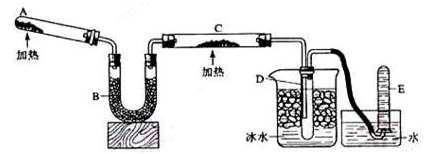
(1)A中制备氨气的反应方程式为。
(2)B中加入的物质是。(填名称)
(3)实验时C中观察到的现象是 。
(4)实验时在D中收集到的液态物质是。(填名称)
(5)已知反应前C中固体的质量为m1g,反应一段时间后停止反应,冷却至室温测量C中固体的质量为m2g,则理论上E中最多收集到的气体体积为(换算成标准状况下的体积)(用m1、m2表示)。
(13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下: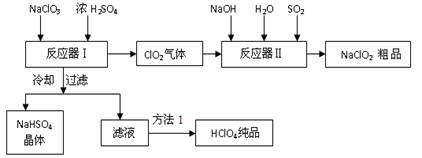
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题:
(1)反应器Ⅰ中冷却的目的是,方法1使用的操作是。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成 NaClO2,请简要说明双氧水在反应中能代替SO2的原因是。
(4)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有,请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式。
浓H2SO4与炭反应,产物成分可用下图装置来确认: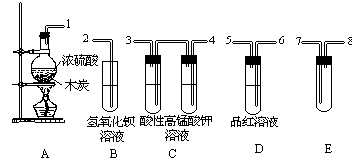
(1)A 装置中反应的化学方程式为;
(2)B 装置中反应的离子方程式;
(3)装置 C 的作用是,E中盛放的试剂是_______;
(4)请用1、2…等标号,写出装置的连接顺序:1-。
已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强。它可用于制备苯甲酸乙酯和苯甲酸铜。
(一)制备苯甲酸乙酯
相关物质的部分物理性质如表格:
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是,反应液中的环己烷在本实验中的作用。
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热。放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷。反应完成的标志是_______。
(3)步骤③碳酸钠的作用是,碳酸钠固体需搅拌下分批加入的原因。
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥。乙醚的作用。
(5)步骤⑤蒸馏操作中,下列装置最好的是________(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热)。
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品。
(6)混合溶剂中乙醇的作用是_______________,趁热过滤的原因________________
(7)本实验中下列药品不能代替氢氧化铜使用的是_____________________
A.醋酸铜B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是________
A.冷水 B.热水C.乙醇 D.乙醇水混合溶液