某研究性学习小组对氨气的制法进行了如下设计:
(1)下面是该小组同学提出的实验室制备氨气的几种方案:
A.硝酸铵固体与氢氧化钠固体共热
B.加热分解NH4Cl晶体
C.将浓氨水逐滴加到新制的生石灰中
你认为其中较为简便易行的方案有_______________(填写字母);其反应的化学方程式为__________________________________。
请从上图的仪器中选择制取氨气的发生装置(要求仪器少、合理)__________(写编号)。
(2)该小组需收集干燥后的氨气:
①如选用如右图所示的装置,则气体应由导管口_______(填“X”或“Y”)导入(集气瓶不能颠倒)。
②若用排液集气法收集氨气,可选用的试剂是_______(填字母)
A.H2O B.浓H2SO4 C.CCl4 D.NaCl饱和溶液
(3)用图示装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是___________
________________________。
(4)若原烧瓶中氨气是充满的,进行喷泉实验后,烧瓶内溶液中溶质的物质的量浓度为_________(假定在标准状况下)。
某课外兴趣小组欲探究铝与盐酸的反应实验中反应速率与哪些因素有关。请填写下列空白:
(1)实验反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、
水槽、胶头滴管、温度计;稀盐酸(4mol/L)、铝条(片)、水。
(3)实验装置(图中铁架台等夹持仪器略去)
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性,具体操作方法是:。
②取3块铝条加入到试管中,操作方法是。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如图。
②试判断OE、EF、FG段所收集气体的多少。
OE:;EF:;FG:。
写出这三个时间段内产生氢气的速率大小比较(用OE、EF、FG表示)。速率大小比较:,在三个时间段反应平均速率变化的原因是。
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):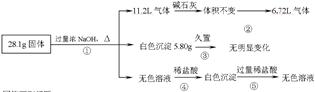
回答下列问题:
(1)混合物中是否存在FeCl2___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4___(填“是”或“否”),你的判断依据是。
(3)写出反应④的离子反应式:__。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
(5)把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体。
。
某班级的探究小组研究氧化铜能否在氯酸钾的受热分解中起到催化剂的作用,设计了如下实验:
(一)制备氧化铜
(1)称取5.0g CuSO4·5H2O晶体,研细后溶解:此步骤需要的仪器有 。
(2)向盛有硫酸铜溶液的烧杯中滴加NaOH溶液,直到不再产生沉淀为止。此步实验现象: ;
离子方程式为: 。
(3) A.把步骤(2)中的溶液和沉淀转移到蒸发皿内,稍微加热至沸腾,搅拌,直到沉淀全部变为黑色固体,停止加热,再过滤、洗涤、干燥、再转移到研钵中研细备用。
B.把步骤(2)中的溶液和沉淀转移到过滤器中过滤,洗涤,将上述沉淀在蒸发皿中进行蒸发,至全部变为黑色固体为止。再转移到研钵中研细备用。
你认为那一个步骤更好,说明理由: 。
(二)证明氧化铜起催化剂作用
设计对比实验①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的ng氧化铜粉末;②将两份氯酸钾同时在相同条件下正确加热,将放出的气体通入水中;③停止加热,冷却,将原先混有氧化铜的反应后混合物加水溶解,小心过滤,得到滤出物,洗涤并干燥;④观察滤出物的颜色和状态;⑤将滤出物和炭粉混和,在密闭容器中高温加热,将反应产生的气体通入澄清的石灰水中,并观察试验现象。
请回答下列问题:
(1)氧化铜作催化剂的理论依据是: 。
(2)以上实验步骤,有一步不够严密,请指出是那一步: (填步骤序号);该步骤应该做何改进? 。
(3)要达到实验目的,还应该再增加一个实验步骤,这个实验步骤是 。
(4)若用另一套实验装置和操作替换第⑤步实验,也可以达到这一步的实验目的,请从图中所给的仪器作出合理选择,将它们连接成一个符合设计者要求的试验装置。
这个实验装置按照气流从左到右的连接顺序是 接 接 接 接 接 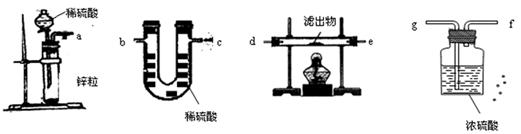
新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α—Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
(1)甲同学用下图所示装置进行α-Fe粉与水蒸气的反应。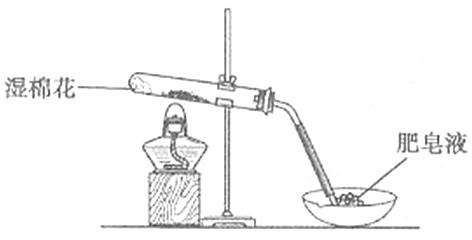
证明实验中有氢气产生的现象是。
(2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。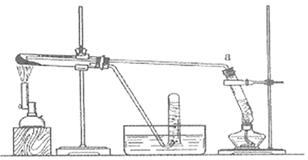
①试管a中的物质是。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 |
实验操作 |
实验现象 |
| Ⅰ |
将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 |
黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ |
向实验I中得到的溶液滴加几滴KSCN溶液,振荡 |
溶液没有出现红色 |
实验现象不能确定是否存在Fe3O4,主要原因是
(用离子方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为mol。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白。(已知二氧化硫能和酸性高锰酸钾溶液发生氧化还原反应。)
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式。
(2)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,不能检出的物质是_____。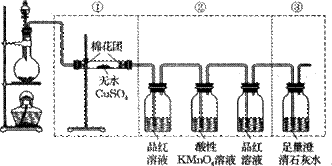
(3)如果将仪器的连接顺序变为①、③、②,则不能检出的物质是_ _ _和,。
(4)如果将第②部分仪器中连接在酸性KMnO4溶液后的装有品红溶液的洗气瓶去掉,则对所作出的结论会有什么影响?
请说明具体原因。