运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)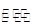 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)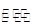 2SO3(g)的正反应为 反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
2SO3(g)的正反应为 反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
②若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1_______K2;若反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
右图是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______________。(ΔH的数值用含字母a、b的代数式表示)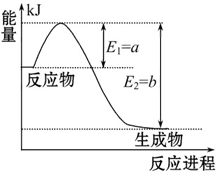
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25 ℃下, 2.0×10-3 mol·L-1的NaCl溶液中逐滴加入适量的2.0×10-4 mol·L-1硝酸银溶液, 白色沉淀生成(填“有”、“没有”)。通过计算解释原因______________________________,向反应后的浊液中,继续加入2.0×10-3mol·L-1的NaI溶液,看到的现象是_____________________________,产生该现象的原因是_____________(用离子方程式表示)。(已知25 ℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16)
按要求进行书写:
(1)氯化钡的电离方程式:___________
(2)氢氧化亚铁在空气中被氧化的化学方程式:___________
(3)过氧化钠与水反应的化学方程式:___________
(4)在化学方程式上用双线桥法表示电子转移的方向及数目:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________,俗称___________,其水溶液显___________性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为___________
___________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者___________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为______________________。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A___________、F___________、H___________。
(2)说出黄绿色气体乙的一种用途___________。
(3)反应⑤的离子方程式为____________。
(4)反应过程⑦可能观察到的实验现象___________。
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为_________________________。
某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍。A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是。
(2)已知:
ⅰ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 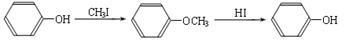
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。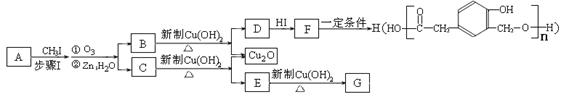
请回答:
①步骤Ⅰ的目的是;
②若G的相对分子质量是44,则E的结构简式是;E的核磁共振氢谱中有个吸收峰(填数字);③ F→H的反应类型是;
④ F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式;
⑤ A的结构简式是;上述转化中B→D的化学方程式是。
(3)已知A的某种同分异构体N具有如下性质:
① N与FeCl3反应,溶液呈紫色;
② N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1molN能与含1molBr2的浓溴水发生取代反应;
④ N分子中苯环上的取代基上无支链。
请写出:N可能的结构简式(写一种即可)。
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol,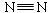 键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式;由键能计算说明此反应是反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =。
键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式;由键能计算说明此反应是反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为,此条件下该反应的化学平衡常数K=;反应达到平衡后,保持温度、容积不变,若向平衡体系中加入0.4 mol N2、 1 mol H2和0.2 mol NH3 ,化学平衡将
向方向移动(填“正反应”或“逆反应”)。
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下: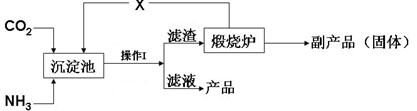
①向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是。操作Ⅰ的名称是。
②煅烧炉中产生的固态副产品为,生产流程中能被循环利用的物质X为。