工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究。
【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度。
【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略)。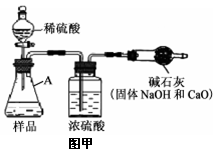
(1)A中发生反应的化学方程式为___________________。
(2)浓硫酸的作用为______。
【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差。你认为下列哪些因素会导致难以避免的误差 ___________________(填序号)。
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
【方案改进】为减少误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)。
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是___________________。
【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将___________________(填“偏高”、“偏低”或“无影响”)。
【拓展提高】已知Na2CO3溶液滴加稀硫酸并不断振荡,先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液。请分析推断反应后所得X溶液的溶质,其所有的可能组成为___________________。
梧州市某中学化学兴趣小组的同学发现,熟鸡蛋在常温下放置一、两天后就会变臭了。富有营养而鲜美的鸡蛋,怎么会散发出臭味呢?同学们旋即对此进行了研究。
【提出问题】这种散发出刺激性臭味的无色气体是什么?它有怎样的性质?
【猜想假设】大家按照查阅到的鸡蛋中主要含有的元素是C、H、O、N、S的信息,及相应元素的化合价,列出了气体的可能存在形式分别有以下几组:
甲组—含碳化合物:CH4、CO、CO2
乙组—含氮化合物:NH3、NO、NO2
丙组—含硫化合物:SO2、SO3
虽然列出了上述可能,但大家都一致提议排除甲组的可能性,大家提出的理由是:__________________。
【查阅资料】
| 物质 |
NH3 |
NO |
NO2 |
SO2 |
SO3 |
| 一些特性 |
碱性 |
在空气中会迅速变成NO2 |
红棕色 |
酸性,有刺激性气味,能使KMnO4溶液褪色 |
沸点44.8℃ |
根据所查阅的资料,大家进一步排除了NO、NO2,理由是___________________;
也排除了SO3的可能,理由是_____________________________________________。
【实验验证】
毫无头绪的同学们向老师请教,老师笑而不语,拿出了两集气瓶的气体M,告诉大家这就是该刺激性臭味气体的主要成分,具有可燃性,至于还有什么性质,让大家在注意防护和试验安全的条件下进行探究。
(1)小吴同学用针筒抽取了部分气体M,注入盛有石蕊试液的试管中,结果没有看到溶液变_________的现象,证明该气体不是NH3;
(2)小周同学设法点燃了气体M,并拿一个干冷的小烧杯罩在火焰的上方,看到烧杯内壁有小水珠出现,说明了M气体中含有_______元素;燃烧后的气体带有刺激性,并能使另一个内壁沾有KMnO4溶液的小烧杯,出现红色褪去的现象,说明M气体中还含有_______元素。
(3)为了进一步探究M气体的组成,小施将3.4g的M气体完全燃烧后,设法将燃烧后所得气体,全部通入如下装置进行中。(注:碱石灰为固体NaOH和CaO的混合物)
经充分吸收后称重,发现A装置增重1.8g,C装置增重6.4g。通过计算可知,除了上述小周确定的两种元素外,M气体中________(填“含”或“不含”)其他元素;并确定了M的化学式为___________。而上图中B装置的作用是___________________;D装置的作用是__________________。经过严谨的思考与细致的实验,同学们终于揭开了这种气体的组成。
实验室中的药品一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组的同学对实验室里久置于空气中变质的过氧化钠(Na2O2)固体的成分进行探究.
【查阅资料】(1)Na2O2的化学性质很活泼,能与水、二氧化碳反应,相关反应的化学方程式为:
2Na2O2+2H2O=4NaOH+O2↑;
2Na2O2+2CO2=2Na2CO3+O2↑
(2)CaCl2溶液为中性
【猜想】
I:固体为Na2O2、NaOH、Na2CO3的混合物
Ⅱ:固体为NaOH和Na2CO3的混合物
Ⅲ:固体为NaOH
Ⅳ:。
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量固体于试管中,加水振荡,直至完全溶解 |
猜想I不成立 |
|
| ②取少量①的溶液于试管中,滴加CaCl2溶液至过量 |
证明有Na2CO3存在 |
|
| ③取少量②的溶液于试管中,加入 |
证明有NaOH存在 |
|
| 综合以上实验现象,说明猜想II是成立的. |
【反思评价】
(1)实验操作②中反应的化学方程式为 ;
注意:若答对下面小题将奖励4分,但化学试卷总分不超过60分。
(2)实验操作②中“滴加CaCl2溶液至过量的目的是;
(3)表格中实验操作③还可以采用方法得到相同结论。
某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验。
实验一:5mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,可观察到现象为______,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为.
实验二:对实验一反应后溶液中的溶质进行探究.
【提出猜想】
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
你认为猜想______不合理,其理由是.
【设计实验】
| 实验操作 |
实验现象 |
实验结论 |
| 取反应后的溶液于试管中,加入_____ _ |
猜想三成立 |
【拓展应用】我国土壤的酸碱性有“南酸北碱”之说法,你认为需向酸性土壤中加入进行改良.
春节期间,小颖你妈妈去医院打点滴,发现护士往输液管上放了一个纸包,经询问得知它是输液恒温贴。可以温暖输入人体中的液体。小颖对包里的东西能产生热量感到很奇,于是,他向护士要了一只输液恒温贴,带回来进行了如下探究。
撕开真空包装封口,解开内衣包装袋,倒出其中的粉末,发现成黑色。
【提出问题】黑色粉末可能含有哪些物质呢?
【猜想与假设】该黑色粉末可能含有碳粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步认证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁能被磁铁吸引。四氧化三铁与盐酸反应生成氯化亚铁,氯化铁和水
【初步结论】黑色粉末可能含有。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末于试管中,加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液变为浅绿色, |
| ② |
将实验①试管中的物质过滤,向滤液中加入足量铁粉 |
有气泡产生,无红色物质析出 |
| ③ |
取实验②滤渣灼烧,将内壁涂有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由上述实验可知,该黑色粉末肯定含有,肯定不含;写出实验①中产生气体的化学方程式.
【交流讨论】
①输液恒温贴真空包装的原因:铁粉在空气中会与发生缓慢氧化转化成铁锈
并放出热量。
②输液恒温贴中炭粉的作用是。
某化学课题小组的同学在学习完了酸、碱、盐后想探究它们之间的性质,他们来到实验室,发现一瓶久置的“碱石灰”(碱石灰的成分是CaO和NaOH的混合物),于是他们进行了如图所示的探究。
【提出问题】:滤液C中的溶质是什么?
【猜想与假设】:小龙同学认为溶质是NaOH,小江同学认为溶质是Na2CO3,小美同学认为溶质是NaOH、Na2CO3,你认为溶质是;
【过程与评价】:
(1)小江同学为了证明自己的猜想,取滤液C少许于试管中,滴加足量的稀盐酸,产生大量气泡,则滤液C中溶质是Na2CO3,写出该反应的化学方程式________________小江同学的评价是否正确?原因是什么————--;
(2)小美同学为了证明自己的猜想,取滤液C少许于试管中,滴加少量的CaCl2溶液,产生白色沉淀,写出该反应的化学方程式_____________.静置,向上层清夜中滴加无色酚酞溶液,无色酚酞溶液变红,则滤液C中的溶质为NaOH和Na2CO3,小美同学的实验结论是否正确?原因是什么?_________________
(3)经过同学们的实验证明,小江同学的猜想是错误的,则滤液C中的溶质是______实验过程中,同学们还发现向样品中加入足量的水溶解时放出大量的热,综合对滤液和滤渣成分的探究,下列对样品成分的分析正确的是______
①样品中一定含有NaOH ②样品中一定含有Na2CO3 ③样品中含有NaOH、CaO中的一种或两种