依据表中的元素所组成初中化学常见的物质,回答下列问题。
| 元素名称 |
氢 |
碳 |
氧 |
氯 |
钠 |
钙 |
| 元素符号 |
H |
C |
O |
Cl |
Na |
Ca |
(1)A、B组成元素相同,一定条件下可发生反应A→B+C,则C物质是______。
(2)D、E、F含有相同的金属元素,F俗称小苏打,已知在溶液中D与F反应生成E和B,则该反应的化学方程式为_____________________。
(3)向某红色溶液中滴加D溶液,溶液颜色经历红色→紫色→蓝色的变化过程,且无气体、无沉淀产生。则原红色溶液中的溶质是_______________,D物质是______________。
(4)向X物质的饱和溶液中加入物质Y,溶液变浑浊,在向其中加入足量稀盐酸,溶液变澄清、无气体产生。则溶液变浑浊的原因是__________[填序号]。
①X是Ca(OH)2、加入的物质Y是CO2,二者发生反应生成CaCO3;
②X是Na2CO3、加入的物质Y是Ca(OH)2,二者发生反应生成CaCO3;
③X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应消耗溶剂使Ca(OH)2析出;
④X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应生成的Ca(OH)2不能再溶解;
⑤X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应放热使Ca(OH)2溶解度减小而析出;
今年地球日主题为:“珍惜地球资源,转变发展方式”。为减少化石燃料的使用,降低污染,各国都在积极进行技术创新。
(1)美国科学家发明了一种“发电叶子”,将这种叶子放入水中,在太阳光照射下,叶子中的催化剂会将水分解成氢气和氧气储存在氢氧燃料电池中,再转化为电能,供家庭用电需求。
①整个过程中都发生了哪些形式的能量转化:。
②“发电叶子”产生氢气、氧气的化学方程式为。
(2)我国积极改进风电技术,扩大风电使用,并配套大型储能设备——“全钒液流”储能电池,以保证稳定供电。
①与煤炭火力发电相比,风力发电的优点是。
②“全钒液流”储能电池在充电时,电池中的VO2+会变成VO2+,这个过程中钒元素(V)的化合价由价变为价。
(3)为了降低汽车排放的尾气对空气的污染,现在的大部分汽车都安装了催化式排气净化器。下图列举的是几种气体在净化器中转换前后的变化。
①根据下图所提供的信息,举例说明催化式排气净化器是如何降低汽车尾气污染的:
。
②气体在催化式排气净化器里面发生了化学变化。请用原子、分子的知识概括化学变化的实质:。
③为了使汽车尾气的污染更小,研究催化式排气净化器的专家们还要注意什么问题:
。
某化学小组围绕燃烧与灭火的主题开展了相关活动。请你参与完成: 【知识回忆】可燃物燃烧的必备条件是、。
【知识回忆】可燃物燃烧的必备条件是、。
【交流讨论】(1)改进后的装置(如图二)与图一相比,其优点是。欲使图二中的红磷着火,可将试管从水中取出并后才能对试管加热;
(2)将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三),结果观察到了“水火相容”的奇观,则大试管所装气体可能是;
【综合应用】“水火不相容”是指水能灭火,其实水有时也可以“生火”,比如钾遇水会立刻着火,因为钾遇水生成氢气和一种叫氢氧化钾的物质,该反应是(填“吸热”或“放热”)反应,其反应化学方程式为。
兴趣小组的同学为了探究木炭在高温条件下还原氧化铜所生成的气体产物是什么,提出了猜想:
a.气体产物可能是二氧化碳;
b.气体产物可能是一氧化碳;
c.气体产物可能是二氧化碳和一氧化碳的混合物。
(1)同学们设计了如下图所示装置(铁架台已略去),通过实验探究气体产物的成分。
已知NaOH溶液能够快速吸收二氧化碳,则装置C的作用是。
实验过程中观察到A、E装置中的澄清石灰水均变浑浊,C装置中的澄清石灰水不变浑浊,由此可得出该气体产物的成分为。装置A、E中发生反应的化学方程式为。
(2)有同学提出,从简约装置、节约实验药品的角度出发,上图装置可进行改进,去掉A、B、C装置,只用D、E装置同样可以探究出该气体产物的成分(如下图所示)。请你写出其实验操作过程(写出操作步骤,不需要写出现象和结论):
。
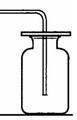
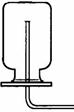
化学实验是学习化学和进行科学研究的重要方法和途径。学会气体物质的制备方法是研究气体、利用气体的基础。请根据下图回答有关问题:
 |
 |
 |
 |
  |
 |
| ① |
② |
③ |
④ |
⑤ |
⑥ |
(1)在常温下实验室欲制取氧气所选用的装置是(填序号),为了便于调控反应的进行,可以对发生装置进行改进,请简要说明你的改进措施。
(2)从上述仪器中选择一种你比较熟悉的仪器,写出它的名称,简要写出它的用途。
(3)同学们以“化学反应中,反应物与生成物的质量关系”为课题进行探究。经讨论分析、查阅资料后设计了A、B两套实验装置,并在实验过程中做到操作规范、准确称量和细致观察。实验完毕后,使用A装置进行实验得到的结果是:反应前后反应物的总质量与生成物的总质量相等;而使用B装置进行实验得到的结果是:反应前后反应物的总质量与生成物的总质量不相等。请分析导致出现两种不同结果的原因是。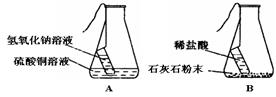
市场上有些食品装在充满气体的塑料袋内,显得鼓鼓的。经询问得知:这样充气的包装,主要是为了使食品能较长时间保鲜、保质和不易压碎。那么,这是什么气体呢?
大明猜想是二氧化碳,小明猜想是氮气。假设大明的猜想正确,请你用实验方法证明:
| 实验操作 |
实验现象 |
实验结论 |