某实验小组根据下图所示装置探究燃烧的条件,请回答问题。 (1)检查装置气密性后,燃烧匙中放入少量的白磷,小烧杯内放入适量的碳酸钠粉末,组装好装置。打开弹簧夹,将溶液A缓慢加入到小烧杯内,溶液A是______,一段时间后,______(填写后续实验步骤和现象),关闭分液漏斗的活塞、弹簧夹,然后用凸透镜加热白磷,观察到白磷不燃烧,该实验过程的目的是______。
(1)检查装置气密性后,燃烧匙中放入少量的白磷,小烧杯内放入适量的碳酸钠粉末,组装好装置。打开弹簧夹,将溶液A缓慢加入到小烧杯内,溶液A是______,一段时间后,______(填写后续实验步骤和现象),关闭分液漏斗的活塞、弹簧夹,然后用凸透镜加热白磷,观察到白磷不燃烧,该实验过程的目的是______。
(2)停止加热,轻轻振荡装置,一段时间后打开弹簧夹,再用凸透镜加热白磷,观察到白磷燃烧,白磷燃烧的原因是______,该实验过程中发生反应的化学方程式为______。
化学兴趣小组的同学对实验室一瓶没有标签的银白色金属X,展开探究活动。
【实验目的】X金属活动性顺序中的相对位置关系。
【实验探究】取形状、大小相同的X、Cu 、Zn三种金属薄片,用砂纸打磨光亮,分别放入三份等体积、等质量分数的稀硫酸溶液中,观察现象。
| 实验 |
X放入稀硫酸中 |
Zn放入稀硫酸中 |
Cu放入稀硫酸中 |
| 实验现象 |
金属X表面产生气泡缓慢 |
金属锌表面产生气泡较快 |
金属铜表面无气泡 |
【实验结论】三种金属在金属活动性顺序中的相对位置由弱到强的是。
【问题与思考】用砂纸打磨金属片的目的是。
【拓展探究】
⑴ 兴趣小组的同学将锌片放入一定量和混合溶液中,反应一段时间后,过滤,对蓝色滤液的组成进行探究。
⑵ 猜想:①滤液中的溶质为硝酸锌和硝酸铜;
②滤液中的溶质为硝酸锌、硝酸铜和硝酸银。
⑶ 请你完成下面实验,验证猜想②成立。
| 实验操作 |
实验现象 |
实验结论 |
| 取少量的滤液于试管中,在滤液中加入。 |
猜想②成立 |
【归纳总结】锌和硝酸银溶液反应的化学方程式是。
小林同学在做探究质量守恒定律实验时,称取2.4g镁条在点燃的条件下与充足的空气反应,其反应的化学方程式为______________________________.实验完毕后,称得所得固体的质量小于4.0g.
【提出问题】固体质量为什么会小于4.0g呢?是否发生了其他反应呢?
【查阅资料】镁在空气中燃烧时,除了镁与氧气反应外,还可发生反应:
①2Mg+CO2点燃C+2MgO② 3Mg+N2点燃Mg3N2
【猜想与假设】反应后固体质量小于4.0g是由于发生反应_______(填“①”或“②”)造成的,其理由是_____________________________.
【实验探究】根据初中化学所学知识用图所示装置除去空气中的氧气得到氮气(含少量稀有气体).可燃物应选择的物质是_________(填写物质的字母代号).
A.木炭 B.红磷 C.硫粉
选择的理由是________________________________________;
将点燃的镁条伸入所制得的氮气中,镁条在氮气中剧烈燃烧.
【实验结论】2.4g镁在空气中完全反应后所得固体质量小于4.0g,是由于生成的产物是___________的混合物所致.
二十一世纪是海洋开发与利用的世纪,某市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。以下是某研究性学习小组在探究海水综合利用中遇到的问题,请你参与探究:
问题一、海水制镁过程中如何富集镁离子?
甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳。
乙:高温加热蒸发海水后,加入石灰乳。
丙:向晒盐后的卤水中,加入石灰乳。
通过分析比较,你认为___________的设想最为经济合理(选填“甲”、“乙”或“丙”)。
问题二、粗盐提纯过程中如何除去可溶性杂质?
【查阅资料】
粗盐中含有硫酸钠、氯化钙等可溶性杂质。
【设计实验】
提纯时,先向粗盐水中加过量的氢氧化钡溶液,目的是_____①________;再加过量的____②______,除尽杂质阳离子;滤去沉淀,向滤液中加入__③_____,将溶液的pH调为7,即得到精盐水。
问题三、海水“制碱” 的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行
了如下探究:
【提出猜想】
甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中只含有氢氧化钠;
丙的猜想:样品中含有碳酸钠和氢氧化钠。
他们做出上述三种猜想的科学依据是________________________________。
【实验、记录与分析】
| 步骤 |
实验操作 |
实验现象 |
结论 |
| 1 |
取少量样品于试管中,加水完全 溶解,再加入________________ |
_____________________ |
乙的猜想 不成立 |
| 2 |
取步骤1反应后的溶液于试管中 ___________________________ |
无明显现象 |
只有甲的 猜想成立 |
【实验结论】
海水“制碱”的最终固体产物是碳酸钠。
【数据分析】
在取回的样品中加入200g7.3%的稀盐酸,恰好完全反应,请计算同学们带回了多少克固体样品?(要求有解题过程)
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。
(1)根据受损标签的情况判断,这瓶试剂不可能是
A.酸B.碱C.盐
(2) 已知 Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.室温(20℃)时,四种物质的溶解度的数据如下图:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 溶解度g |
36 |
109 |
215 |
9.6 |
根据试剂瓶标注的溶质质量分数10%和右表中的溶解度的数据判断,这瓶试剂不可能是。
(3) 用pH试纸上测得该溶液的pH>7,这瓶试剂不可能是。
(4) 为了确定该溶液是哪种溶液,现进行如下进一步的实验:
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 取样于试管中,滴加 |
产生大量的气泡 |
该溶液是,反应的化学方程式 |
(5)还可以选择与(4)中不同的试剂确定该溶液,你选择的试剂是(要求类别不同)。
(6) 为了探究一瓶氯化钙溶液的质量分数,取该溶液50g,加入50g碳酸钾溶液,恰好完全反
应,所得溶液质量95g,计算此氯化钙溶液的质量分数。
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
久置固体中可能含有Ca(OH)2的原因是:
用化学方程式表示。
实验探究1:甲同学的方案(见下表)。
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 |
固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 |
固体中一定含有 和氢氧化钙 |
| (2)另取少量固体放于试管中,滴加足量 的 |
固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 |
固体中一定含有, 一定不含有Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 |
固体中一定含有CaCO3 |
实验质疑:(1)乙同学认为甲同学的实验中的实验中不能得出一定含有Ca(OH)2的结论,理由是。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是。
实验探究2:乙、丙同学设计如下图所示实验方案继续验证。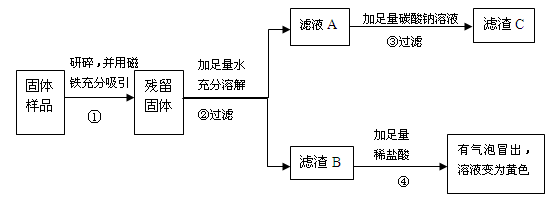
(1)③中反应的化学方程式是。
(2)乙、丙同学实验中又能得出固体样品中一定还含有,
仍有一种物质不能确定,该物质是。