(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示: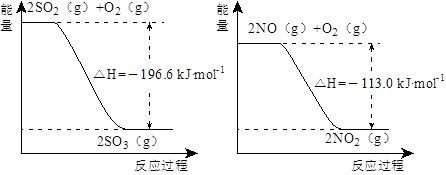
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g)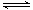 N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| 总压强p 100 kPa |
5 |
5.6 |
6.4 |
6.8 |
7 |
7 |
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示: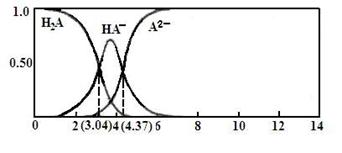
已知:103.04=1.1×103,104.37=2.3×104 25℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值 (填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值 。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2= 。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: 。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。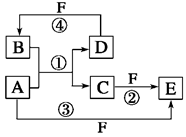
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A 是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A原子的结构示意图为,反应④的化学方程式为_______________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①和②均在水溶液中进行,写出反应②的离子方程式_________,E与A再生成C的离子方程式是。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为___________________________________。
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为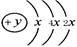 ;B、C可形成离子化合物B3C2,
;B、C可形成离子化合物B3C2,
据此利用相应的化学用语填空:
(1)A元素在周期表中的位置是,其气态氢化物的化学式为。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为。
(3)B和C最高价氧化物对应水化物的化学式分别为和。
下列七种物质中 Ne O2 H2O NH3 H2SO4 KOH MgCl2
只含有共价键的是,只含有离子键的是,既含有离子键又含有共价键的
是属于共价化合物的是,属于电解质的是。(填化学式)
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
⑴在人体中进行的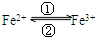 转化时,②中的Fe3+作剂;
转化时,②中的Fe3+作剂;
⑵ “服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作剂,具有性。
⑶市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为。
碘缺乏症遍及全球,多发生于山区,南美的安第斯山区,欧洲的阿尔卑斯山区和亚洲的西马拉雅山区是高发病地区。我国云南、河南等十余个省的山区的发病率也较高。为控制该病的发生,较为有效的方法是加碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾。可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾,反应的化学方程式为,氧化剂是,
还原剂是,能观察到的明显现象是。