(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。
⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应的离子方程式为□VO2+ +□H2C2O4+□_____=□VO2++□CO2↑+□H2O,试将其配平。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ +V2++2H+  VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g)  2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g)  2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25[ |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是______(填“A”或“B”);比较р1、р2的大小关系_______。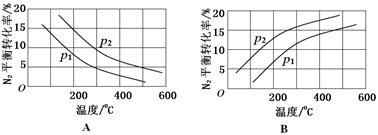
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1
2NH3(g)△H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________;
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________;
(3)a的取值范围是_______________________________________。
(10分)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
(1)该反应的化学方程式为______.
(2)反应开始至2min,用X表示的平均反应速率为______ mol·L-1·min-1;
平衡时,Y的转化率为______,
平衡时,Z的浓度为______ mol·L-1。
(3)下列叙述能说明上述反应达到平衡状态的是______(填选项、多选)
| A.X、Y、Z的物质的量之比为3:1:2 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.混合气体的总物质的量不随时间的变化而变化.
实验题:将V1 mL 1.0 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:
(1)该实验表明此反应(填吸收、释放)能量,即:能可以转化为能,通过图示分析可以得出:做该实验时,环境温度(填高于、低于、等于)22 ℃;
(2)根据图示计算该NaOH溶液的浓度约是mol·L-1
(3)如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是_________(填序号)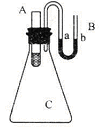
根据下面的描述,按照要求回答下列问题
(1)画出H2O2的电子式:__________
(2)请画出HClO的电子式:__________
(3)用电子式表示出离子化合物MgCl2的形成过程__________
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是__________,画出电子式_________
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸镁的平均反应速率是__________mol·L-1s-1。