(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。
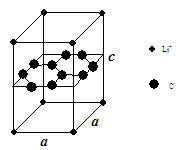
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
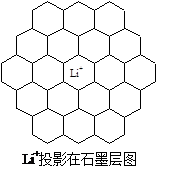
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| |
BeCO3 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
| 分解温度 |
100℃ |
540℃ |
960℃ |
1289℃ |
1360℃ |
写出BeCO3分解的化学方程式 。
分解温度为什么越来越高? 。
实验室里需要纯净的氯化钠溶液,但手边只有混有Na2SO4、NH3HCO3 等杂质的NaCl。某学生设计了如下图方案提取纯净物的NaCl溶液。(已知:NH4HCO3  NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
如果此方案正确,那么:
(1)操作①可选择 或_____ (仪器)。
(2)操作②为什么不用加硝酸钡溶液?其理由是 。
(3)进行操作②后,如何判断SO42-已除尽的方法是___________________ 。
(4)操作③的目的是________________,为什么不先过滤后加碳酸钠溶液,理由是______________ 。
(5)操作④的目的是_________________________________。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
① A + B→白色沉淀,加入稀硝酸,沉淀不溶解
② B + D→白色沉淀,在空气中放置,沉淀由白色迅速变为灰绿色,最后转化为红褐色
③ C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
(1)试推断A B C D (化学式)。
(2)写出下列反应的化学方程式或离子方程式:
①实验中沉淀由白色迅速变为灰绿色,最后转化为红褐色的化学方程式
②C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中的离子方程式 。
胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;(4)遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有引起溃疡穿孔的危险。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;(2)凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液。
(1)请你推测,甲中含有的主要化学成分是 (填化学式,下同);乙中含有的主要化学成分是 。
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程式
(3)试写出实验室以氨水为原料制备乙中含有的主要化学成分的离子方程式
(1)除去混入NaCl溶液中少量Na2CO3杂质的试剂是 ,离子方程式为
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为
(3)除去铁粉中混有铝粉的试剂是 ,离子方程式为
(4)除去FeCl2溶液中混有FeCl3的试剂是 ,离子方程式为
镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)溶液①中含金属元素的离子是_________________。
(2)用离子方程式表示加入双氧水的目的___________;双氧水可以用下列物质替代的是_______。
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是_____________;操作C的名称是______________。
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为_____________;请选择合适的试剂,设计实验证明产品中是否含“杂质” ______________。
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M  MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。