如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请
根据该装置回答下列问题: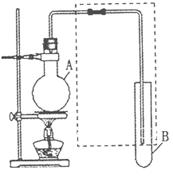
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A
中加入的试剂在混合时的操作方法是___________,反
应的化学方程式为___________ ,试管B中应
加入___________ 。虚线框中的导管除用于导气
外,还兼有___________ 作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A
中除加入1-丙醇与乙酸外,还应先加入适量的试剂
___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________ ,试管B中应加入___________。
氨基甲酸铵(NH2COONH4)是一种白色固体,在干燥空气中稳定,但在湿空气中则放出氨而变成碳酸氢铵、59℃时分解为氨及二氧化碳、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)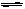 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用图1装置制取氨气,你所选择的试剂是。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。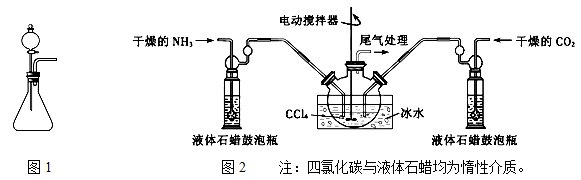
①发生器用冰水冷却的原因是_____________________________。
液体石蜡鼓泡瓶的作用是______________________________。
②从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。 为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干b. 高压加热烘干c.真空40℃以下烘干
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为___________。
可逆反应3A(g) 3B(?)+C(?)(正反应吸热)达到化学平衡后,
3B(?)+C(?)(正反应吸热)达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量;
②若B是气体,C不是气体,气体的平均相对分子质量;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是态(填气态或非气态)。
(3)如果B为气体,C为固体,取3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L。若使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,则C的取值范围应该是。
(1)已知:下列两个热化学方程式:Fe(s) + 1/2O2(g)  FeO(s)
FeO(s) =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)
Al2O3(s)  =-1675.7KJ/mol则Al(s)的单质和FeO(s)反应的热化学方程式是_。
=-1675.7KJ/mol则Al(s)的单质和FeO(s)反应的热化学方程式是_。
(2)右图表示在密闭容器中反应:2SO2+O2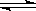 2SO3;
2SO3;  <0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是;bc过程中改变的条件可能是;
<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是;bc过程中改变的条件可能是; 
(3)若增大压强时,将反应速度变化情况画在c—d处
气体化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体能分解生成15mLO2和10mLF2(同温同压下),则A的化学式是,推断的依据是和。
在VmLFe2(SO4)3溶液中含Fe3+ m g,取该溶液V/4mL,加水稀释至4VmL,则此稀溶液中SO42—的物质的量浓度为mol/L。