(12分)分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式(不考虑同一碳原子上连两个羟基),并回答相关问题:
(1)甲分子中没有甲基,且1 mol甲与足量金属Na反应生成1 mol H2,还能与NaHCO3溶液反应,则甲的结构简式为 ,该物质 溶于水(填“难”或“易”), 原因是 ,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是 。
(2)乙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且乙与金属Na不反应,则乙结构简式为 ,该物质属于 类化合物(填“醇”、“醛”、“羧酸”或“酯”),它的液体密度应比水 。
某溶液中可能含有H+、Na+、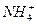 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、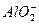 、
、 、
、 、
、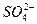 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验:
(1)气体A的成分是______________,气体B的成分是_______________。(填化学式)
(2)X溶液中一定存在的离子是_______________。
(3)写出步骤①中发生反应的所有的离子方程式_______________。
(4)写出步骤②中形成白色沉淀甲的离子方程式_______________。
(5)通过上述实验,白色沉淀乙的组成可能是_______________;只要设计一个简单的后续实验就可以确定该沉淀的组成,该方法是______________________________。
(1)在新生代的海水里有一种铁细菌,它们摄取海水中的亚铁离子,把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;用酶作催化剂时反应的另一个反应物是CO2,它在反应后转变成有机物,可用甲醛来表示,试写出离子方程式,并配平为_____________________;
(2)地球化学家用实验证实,金矿常与磁铁矿共生的原因是:在高温高压的水溶液(即所谓“热液”)里,金的存在形式是[AuS]-络离子,在溶液接近中性时,它遇到Fe2+会发生反应,同时沉淀出磁铁矿和金矿,试写出离子方程式,并配平为___________________________。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、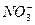 、
、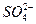 、Cl-、I-、
、Cl-、I-、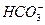 ,取该溶液实验如下:
,取该溶液实验如下:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和稀硫酸,加热 |
有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是________________________________,
溶液中肯定不存在的离子是___________________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤)。
星形聚合物
可经下列反应路线得到(部分反应条件未注明)

(1)淀粉是糖(填"单"或"多");
的名称是。
(2)乙醛由不饱和烃制备的方法之一是(用化学方程式表示,可多步)。
(3)
的化学反应类型属于反应;
结构中有3个相同的基团,且1
能与2
反应,则D的结构简式是;
与银氨溶液反应的化学方程式为。
(4)
的直链同分异构体
的分子中不含甲基,
既不能与
溶液反应,又不能与新制
反应,且1
与足量
反应生成1
,则
的结构简式为。
(5)
有多种脱水产物,其中两种产物的结构简式为和。