下图是研究铜与浓硫酸的反应装置: 
(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
| 资料1 |
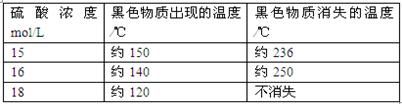 附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 |
X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
仅由上述资料可得出的正确结论是 。
A.铜与浓硫酸反应时所涉及的反应可能不止一个 B.硫酸浓度选择适当,可避免最后产物中出现黑色物质;C.该反应发生的条件之一是硫酸浓度≥15 mol·L D.硫酸浓度越大,黑色物质越快出现、越难消失
在一定条件下,可逆反应:mA + nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m + n_____p
(填“>”“<”或“=”)
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m + n = p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(填放热或吸热)。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各小题:
⑴反应达到平衡时,平衡常数表达式K=______,升高温度,K值____(填“增大”、“减小”、“不变”)。
⑵在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=__________________。
(用上图中出现的字母表示)
⑶在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是______________________。
a.氢气的浓度减小b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加d.重新平衡时n(H2)/n(CH3OH)增大
⑷据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
⑸能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的能量,写出甲醇燃烧热的热化学方程式__________。
在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
⑴从0~4 min,该反应的平均速率v(CO)=mol/(L·min)。该反应的平衡为。
⑵为了增大CO的转化率,可以采取的措施有。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为mol/L。
在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。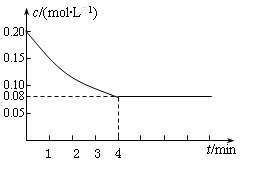
⑴从0~4 min,该反应的平均速率v(CO)= mol/(L·min)。该反应的平衡为 。
⑵为了增大CO的转化率,可以采取的措施有 。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 mol/L。
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)==3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
⑴可认定上述可逆反应在一定条件下已达到化学平衡状态的是(选填序号)。
A、体系压强不再变化 B、v正(A)=2v逆(B)
C、体系的密度不再变化 D、混合气体的平均相对分子质量不再变化
⑵如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:
C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是
A、4molA+2molB B、6molC+1molD
C、1molA+0.5molB+1.5molC+0.5molD D、2molA+1molB+3molC+1molD
E、2molA+1molB+3molC+2molD
⑶若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是(用含W的代数式表示)
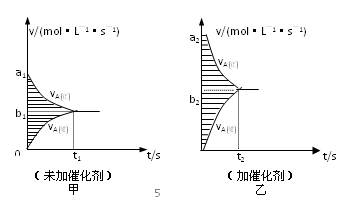
⑷此反应的v—t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则
其v—t图象如乙图,请用“=、<、>”填空:①a1a2;②b1b2;③两图中
阴影部分面积:甲乙。