Ⅰ(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等。
①Cu位于元素周期表第四周期第 族。
②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。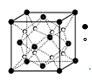
Ⅱ(3)液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
①写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
②下列能说明碳与硫两元素非金属性相对强弱的是 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
③羰基硫在水存在时会缓慢水解生成H2S,使溶液的pH约为6.5左右,此时钢铁设备会产生的电化学腐蚀主要是 。
【化学——选修3:物质结构与性质】
W、M、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为。
(2)MX3-的空间构型(用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是___________________
_______________________________________________________________________。
(4)根据等电子原理,WX分子的结构式为。
(5)1 mol WX2中含有的σ键数目为。
(6)H2X分子中X原子轨道的杂化类型为。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式。
【化学——选修2:化学与技术】
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂。湿法生产过碳酸钠的原理和线路如图所示(BC—1,BC—2均为稳定剂):
请回答下列问题:
(1)H2O2中添加BC—Ⅰ的目的是;工业纯碱中常含有微量Fe3+,加入BC—2可与Fe3+形成配合物,这样做的原因是。
(2)过碳酸钠在高温下容易分解,所以制取时反应需控制在5℃以下进行。在反应釜中发生的主要反应为;常温结晶的过程中加入氯化钠、搅拌,作用是。
(3)下列关于过碳酸钠使用和保存的说法不正确的是。(填字母标号)
A.应与易燃或可燃物、还原剂等分开存放
B.使用时避免与眼睛、皮肤和衣服接触
C.储存于干燥洁净、不通风的仓库内
D.过碳酸钠不慎溅入眼睛应用流动清水或生理盐水冲洗,并就医
(4)过碳酸钠是一种很好的消毒剂,下列与其消毒原理相似的是。(填字母标号)
A.乙醇 B.漂粉精C.二氧化硫 D.过氧化钠
(5)工业上常以所含活性氧的质量分数 衡量过碳酸钠产品的优势,13%以上为优等品。取2g某厂家生产的过碳酸钠样品(所含杂质不参加反应)溶于水配成溶液,加入足量MnO2,反应完全后溶液质量减轻0.264g,则该样品中活性氧的质量分数为 。
衡量过碳酸钠产品的优势,13%以上为优等品。取2g某厂家生产的过碳酸钠样品(所含杂质不参加反应)溶于水配成溶液,加入足量MnO2,反应完全后溶液质量减轻0.264g,则该样品中活性氧的质量分数为 。
汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)10-4 mol/L |
10.0 |
4.50 |
C1 |
1.50 |
1.00 |
1.00 |
| C(CO)10-3 mol/L |
3.60 |
3.05 |
C2 |
2.75 |
2.70 |
2.70 |
①c1合理的数值为。(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)=。
③不能作为判断该反应达到平衡状态的标志是。(填字母标号)
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验 编号 |
T/oC |
NO初始浓 度/10-3mol·L-1 |
CO初始浓 度/10-3mol·L-1 |
催化剂的比 表面积/m2·g-1 |
| ① |
350 |
1.20 |
5.80 |
124 |
| ② |
280 |
1.20 |
5.80 |
124 |
| ③ |
280 |
1.20 |
5.80 |
82 |
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为。
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=。
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650oC下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为。
已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16,乙、丙的摩尔质量相同,B的摩尔质量比D小2,B、X的摩尔质量相同。各物质之间的转化关系如图所示(各反应条件略)。
请回答:
(1)在B与二氧化碳的反应中,每有1mol电子转移,生成气体L(标准状况)。
(2)X与Y的溶液混合后,再加入适量盐酸,会有乙生成,反应的离子方程式是。
(3)将C通入溴水中,所发生反应的离子方程式是。D中含的化学键类型为。
(4)在101KPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37KJ的热量,该反应的热化学方程式 是
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5。已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为(M要用元素符号表示)。写出MH5与AlCl3溶液反应的化学方程式
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种分子为 (填化学式);1mol Fe(CN)63-中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。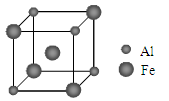
该合金的化学式为 。
B.[实验化学]
工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】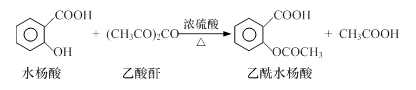
【物质性质】
| 试剂 |
沸点(℃) |
溶解度 |
化学性质 |
||||
| 水杨酸 |
211 |
微溶于冷水,易溶于热水 |
|
||||
| 乙酸酐 |
139 |
在水中逐渐分解 |
|
||||
| 乙酰水杨酸 |
微溶于水 |
与碳酸钠反应生成水溶性盐 |
【实验流程】
(1)物质制备:向125 mL的锥形瓶中依次加入4 g水杨酸、10 mL乙酸酐(密度为1.08g/mL)、0.5 mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10 min。
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是 。
②控制反应温度85℃~90℃的原因 。
(2)产品结晶:取出锥形瓶,加入50 mL蒸馏水冷却。待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干。简要叙述如何洗涤布氏漏斗中的晶体? 。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸3.6 g。
①试剂X为 。
②实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是 。