在标准状况下,①4g氢气 ②33.6 L甲烷 ③6.02×1023个水分子,含分子数最多的是(填序号,下同) ,含原子数最多的是 ,质量最大的是 ,体积最小的是 。
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。
(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”=;
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
H2(g)+O2(g) 2H2O(l)△H=-483.6 kJ/mol
2H2O(l)△H=-483.6 kJ/mol
N2(g)+2O2(g) 2NO2(g)△H=+67.8 kJ/mol
2NO2(g)△H=+67.8 kJ/mol
N2(g)+3H2(g) 2NH3(g)△H=-92.0 kJ/mol
2NH3(g)△H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为。
(2)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是。
(4)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(HCO3-) > c(CO32-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx,反应原理为:
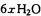 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):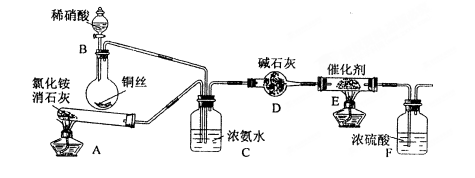
①装置A中发生反应的化学方程式为。
②装置D中碱石灰的作用是。
(2)工业上也常用Na2CO3溶液吸收法处理NOx。已知:NO不能与Na2CO3溶液反应,
NO+ NO2+Na2CO3=2NaNO2+ CO2;2NO2+Na2CO3= NaNO2+ NaNO3+CO2.
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是(填字母)。
A.1.3 B.1.6C.1.8
②将1 mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO—3、NO—2两种离子的物质的量随x变化关系如图所示:
图中线段a表示离子随x值变化的关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少g。
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题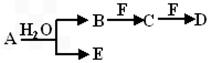
(1)若常温下A为有色气体
①若F是一种金属单质,请写出B和适量F反应生成C与气体E的离子方程式:______________________________。
②若C为直线型分子,E具有漂白性,物质F焰色反应呈黄色,请写出工业上制备物质F的化学反应方程式:___________________;_______________。
(2)若A为淡黄色固体,则A物质的电子式为:_________________。
①若物质B和D的相对分子质量相等,物质C的大量排放往往会造成严重的环境问题即__________;
②若物质A和D的相对分子质量相等,请用离子方程式表示物质F的水溶液呈酸性的原因__________。
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的1/5,将B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,请写出A的化学式________。
化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为。
(2)已知反应Fe(s) +CO2(g)  FeO(s) +CO(g)ΔH ="a" kJ/mol
FeO(s) +CO(g)ΔH ="a" kJ/mol
测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K=,a0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |