(14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
工业上常用电解熔融AD2制取A的单质。 |
B的最外层电子数比最内层电子数多1。 |
C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 |
D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
请按要求回答下列问题:
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
(12分)工业制硝酸的主要反应之一是:
(1)若反应起始的物质的量相同,下列关系图错误的是________ (填编号)。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2的平均反应速率为________mol/(L ? min)。
②反应在第2min时改变了条件,改变的条件可能是________ (填编号)。
A 增加O2的浓度 B.升高温度 C.减小压强D.使用催化剂
(3)将一定量铝粉和铁粉的混合物与上述反的稀硝酸充分反应,反应过程中无气体放出(氧化物产生)。在反应结束后的溶液中,滴加5mol/L的NaOH溶液,所加NaOH溶液(mL)与产生的沉淀的物质的量关系如图所示则:
EF段反应的离子方程式是_______________;铝粉与铁粉的物质的量之比是_____________
硝酸溶液中含HNO3的物质的量是__________mol。
(8分)燃煤废气中的氮氧化物 、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物。如:
则CH4 ( g)将NO2 (g)还原为N2(g)等的热化学方程式是________________________________
(2)将燃煤废气中的CO2转化为甲醚的化学方程式为:
 。已知在一定压强下,该反应随温度的升高而CO2的转化率降低。则该反应的
。已知在一定压强下,该反应随温度的升高而CO2的转化率降低。则该反应的 ________ 0(填“ >”或“ <”);若用以甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池,则该电池中负极的电极反应式是________________________________,放电过程中溶液的PH________ (填“增大”、“减小”或“不变”)。
________ 0(填“ >”或“ <”);若用以甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池,则该电池中负极的电极反应式是________________________________,放电过程中溶液的PH________ (填“增大”、“减小”或“不变”)。
(6分)处理含CN-(其中C为+ 2价)的工业废水常用Cl0_氧化,生成的CNO (其中C为+4价),反应的离子方程式为:
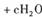 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答:
(1)该离子方程式中e:f的值是________(填选项标号)。
| A.0.5 | B.1 | C.2 | D.不能确定 |
(2)若d="e" =l,则b=________
(3)若反应中转移1.2mol电子,则生成的气体在标况的体积是________。
(12分)A、B、C、D、E五种均为短周期元素,原子序数依次增大。A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成化合物X’X可以使溴水褪色。A元素的单质和C元素的单质化合可生成Y, Y晶体中无分子,也无A、C的离子。A、B元素的单质一定条件下反应生成化合物M,D、B元素的单质反应生成化合物N,化合物M和化合物N的相对分子质量相等,且馅色反应均呈黄色。
请回答下列问题:
(1) 元素C的气态氢化物是________分子(填写“极性”或“非极性”)。
(2) B2D2的电子式是________________
(3) X可以使溴水褪色,该反应的离子方程式是________________________。
(4) 化合物M与化合物N的水溶液反应,若氧化剂与还原剂物质的量之比为1: 1,该反应的离子方程式是________
(5) 右图是BE晶体的一个“晶胞结构”示意图。下列说法正确的是________________。 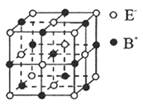
A.与B+距离相等且最近的E_共有6个
B.—个BE晶胞中含有1个B +和1个E_
C.与B+距离相等且最近的B+有8个
D.与B+距离相等且最近的构成的空间结构是正八面体
(6) 将原子序数介于B、C两元素之间的单质、单质B与水反应所得的溶液构成原电池,负极的电极反应式是:O
(10分)化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1) 从物质的分类角度看,不恰当的一种物质是________。(填写化学式)
(2) "三酸”的稀溶液均能作为NH3的吸收剂广三酸”中的任意“一酸”与KH3反应的离子方程式是________________________________
(3) 纯碱生产工艺是沿用化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下: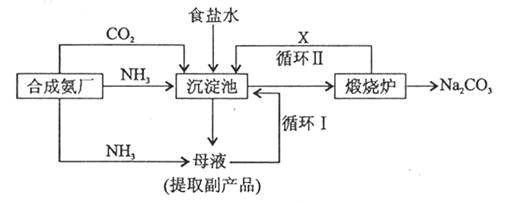
①沉淀池中发生的化学反应方程式是________________
②使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环________ (填“ I ”或“II”)。
(4) 若将1mol/L盐酸逐滴加入0.5mol/L烧碱溶液至恰好完全中和,所得溶液中的离子浓度大小顺序是________________________