现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有粉末)中金属铜的含量
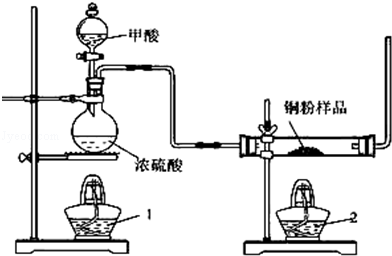
(1)制备一氧化碳的化学方程式是;
(2)试验中,观察到反应管中发生的现象是;尾气的主要成分是;
(3)反应完成后,正确的操作顺序为(填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节);
②写出有关反应的化学方程式.
氯化钠溶液中混有硫酸钠、氯化钙溶液和淀粉胶体。选择适当的试剂盒方法从中提纯出氯化钠晶体。相应的实验过程如下:
(1)写出上述实验过程中所用试剂(写化学式):
试剂① ;试剂③ 。
(2)判断试剂①已过量的方法是: 。
(3)用离子方程式表示加入试剂②的作用: 。
(4)操作①时利用半透膜进行分离提纯。
操作①的实验结果:淀粉 (填“能”或“不能”)透过半透膜;
硫酸根离子 (填“能”或“不能”)透过半透膜;
请用实验证明上述结果,完成下表(可不填满,也可增加):
限选试剂:1mol/L硝酸银溶液、1mol/L氯化钡溶液,1mol/L硝酸钡溶液、碘水、稀盐酸、稀硝酸
| 编号 |
实验操作 |
预期现象和结论 |
| ① |
||
| ② |
实验室用63%的浓硝酸(其密度为1.4g/mL)配制240mL0.50mol/L稀硝酸,若实验仪器有:A 10mL量筒 B 50mL量筒 C 托盘天平 D 玻璃棒 E 100mL容量瓶 F 250mL容量瓶 G 500mL容量瓶 H 胶头滴管 I 200mL烧杯。
(1)此浓硝酸的物质的量浓度为 mol/L
(2)应量取63%的浓硝酸 mL,应选用 。(填仪器的字母编号)
(3)实验时还需选用的仪器有(填序号)
| A.I、 (4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)。 ①量取浓硝酸的量筒用蒸馏水洗涤2~3次,丙把洗涤液转入容量瓶 ②容量瓶使用时未干燥 ③溶解后未经冷却就移液 ④定容时不小心又少量蒸馏水滴到瓶外 ⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线 (5)容量瓶是一种颈部细长的梨形瓶,哟与其颈部细长,所以在向容量瓶中移入液体时,需要一定耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是 |
| B.可以按此建议改进,便于使用容量瓶 |
| C.不能按此建议改进,因为会降低容量瓶的精确度 |
| D.不必加粗瓶颈,因为向容量平中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
实验室用下列仪器和药品制取并收集干燥纯净的氯气。
(1) 盛有浓盐酸的仪器名称是___________________。
(2)按气流从左到右,装置正确的连接是:a 接()、()接()、()接()、()接()(填各接口字母)
(3)装置F 的作用是__________,装置B 的作用是____________。
(4)装置E 中发生反应的化学方程式是____________________。
(5)装置A 中发生反应的化学方程式是_________________________,
若A 中有4.48L 氯气产生(标准状态下),则参加反应的HCl有_______________g。
某实验室从化学试剂商店买回密度为1.84g/cm3、质量分数为98%的“化学纯”硫酸。现用该浓硫酸配制90mL、1mol/L的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有___________(选填序号),还缺少的仪器有__________。
(2)配制100mL 1mol•L-1的稀硫酸需要上述浓硫酸的体积为________ mL(保留一位小数),量取浓硫酸时应选用_______(选填①10mL、②50mL、③100mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是________
| A.容量瓶中原来含有少量蒸馏水 |
| B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容 |
| C.烧杯没有洗涤 |
| D.向容量瓶中加水定容时眼睛一直仰视刻度线 |
(4)若实验过程中出现如下情况应如何处理?加蒸馏水不慎超过了刻度线_______
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。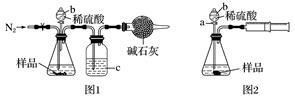
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是 。实验开始前,打开止水夹,先通入N2,,通入N2的作用是_______________________________;一会后,连接上干燥管,打开b的活塞,滴下稀硫酸,充分反应后,再通入N2的目的 。
(2)乙同学用图2所示装置,取一定质量的样品(m g)和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的__________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验: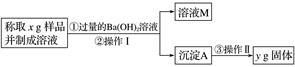
①操作Ⅰ涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得的样品中Na2CO3质量分数的计算式为__________。