下列有关物质“量”的说法正确的是 ( )
A.相同质量的Al和Al2O3分别与等浓度的NaOH溶液反应,至体系中均无固体物质时,Al2O3消耗碱量多
B.反应N2O4+N2H4→N2+H2O中,若有1 mol N2O4参加反应,则有4 mol电子发生转移
C.由Na2CO3和NaHCO3组成的混合物中,若n(Na+):n(C)=7:5,则n(Na2CO3):n(NaHCO3)=2:3
D.1 mol Cl2参加的任何反应,反应过程中转移电子数都是2 NA
下列说法正确的是( )。
| A.乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底 |
| B.把乙烯通入溴水中,溴水立即褪色,这是由于乙烯具有漂白性 |
| C.煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化 |
| D.苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应 |
下列有关有机反应类型的判断错误的是( )。
下列有关有机化学反应之间的逻辑关系中正确的是( )。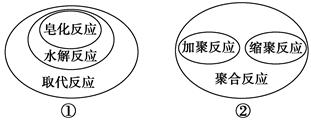
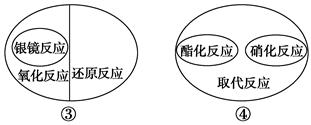
| A.①②④ | B.①③④ | C.①②③④ | D.①②③ |
下列除去杂质(括号内为杂质)的方法正确的是( )。
①乙烷(乙烯)光照条件下通入Cl2,气液分离 ②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液 ③苯(乙酸)用氢氧化钠溶液洗涤、分液 ④乙醇(乙酸)加足量生石灰、蒸馏
| A.①②③ | B.②③④ | C.①③④ | D.①②④ |
下列说法正确的是( )。
| A.淀粉、油脂和蛋白质都是高分子化合物,且它们均为混合物 |
| B.煤、石油和天然气都是化石燃料,且它们均不能再生 |
| C.果糖、蔗糖和麦芽糖都能发生水解反应,且产物均为葡萄糖 |
| D.乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 |