用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG="lg" [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是:
| A.Ca2+、K+、Cl-、SO32- | B.NH4+、Fe2+、 I一、SO42- |
| C.Na+ 、K+、ClO-、S2- | D.Na+、S2O32-、AlO2—、K+ |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O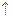 。下列说法正确的是()
。下列说法正确的是()
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极接直流电源的负极 |
| D.当有0.1mol电子转移时,有0.1molCu2O生成。 |
下列措施不能达到节能减排目的的是
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替白炽灯 |
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
A.上述实验证明氧化性:MnO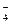 >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D.实验②证明Fe2+既有氧化性又有还原性 |
硫酸铵在强热条件下分解生成NH3、SO2、N2和水的反应中氧化产物和还原产物的物质的量之比是( )
| A.2:3 | B.4:3 | C.1:1 | D.1:3 |
根据下列三个反应的化学方程式,下列关系式正确的是( )
① I2+SO2+2H2O=H2SO4+2HI② 2FeCl3+2HI=2FeCl2+2HCl+I2③ 2FeCl2+Cl2=2FeCl3
| A.氧化性:Fe3+>Cl2>H2SO4>I2 | B.还原性:SO2>I->Fe2+>Cl- |
| C.Fe与I2化合:2Fe+3I2 =2FeI3 | |
| D.FeI2溶液中通入少量的Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |