(共8分)过氧化氢水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液移至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- + H2O2 + H+ ="===" Mn2+ + H2O + ( )
(3)移取10mL过氧化氢溶液可以用_______(填“酸式”或“碱式”)滴定管。滴定到达终点的现象是___ 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果______(填“偏高”或“偏低”或“不变”)。
氨基甲酸铵是一种用途广泛的化工原料。有关它的资料如下:①常温下,在干燥的空气中稳定,遇水或潮湿空气则生成碳酸铵或碳酸氢铵;②熔点58℃,59℃则可分解成NH3和CO2气体;③在密封管内加热至120℃~140℃时失水生成尿素[CO(NH2)2];④酸性溶液中迅速分解;⑤合成氨基甲酸铵原理为: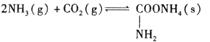

(1)写出氨基甲酸铵在密封管内加热至120°C~140°C生成尿素的反应方程式:_______________
(2)仪器B名称________;盛放药品是: ________;
(3)合成氨基甲酸铵的反应在一定条件下能自发进行,该反应的反应热ΔH_____0(填“>” “=”或“<”)
(4)有同学建议该CO2发生装置直接改用“干冰”,你认为他的改进有何优点:(回答二点)
①________________;②________________
(5)该实验装置中有明显导致实验失败的隐患有:(指出主要二处)
①________________;②________________
某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去)。A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。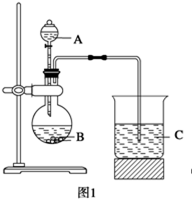
(1)甲同学设计实验所涉及的离子方程式为_________________、_______________;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内,可观察到;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应。写出该操作中主要离子方程式为。
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观到;
(3)根据甲乙同学的实验可得到的结论是:。
如图是一个制取氯气并以氯气为原料进行特定反应的装置。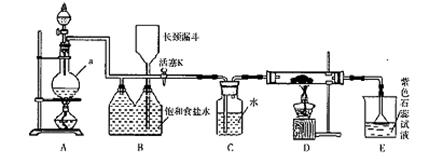
(l)A是氯气发生装置,写出其中的化学反应方程式。
(2)a仪器的名称为 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式,装置C的作用是。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B
中的现象是;若发现装置B中该现象不明显,可能的原因是;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式。
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究____________对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持______________条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是_____________;应该测定的实验数据是____________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(15分)S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
① CS2+3Cl2 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。
已知:S2Cl2易与水反应,S2Cl2+Cl2 2SCl2。
2SCl2。
下列是几种物质的熔沸点和反应装置图:
| 物质 |
沸点/℃ |
熔点/℃ |
| S |
445 |
113 |
| CS2 |
47 |
-109 |
| CCl4 |
77 |
-23 |
| S2Cl2 |
137 |
-77 |
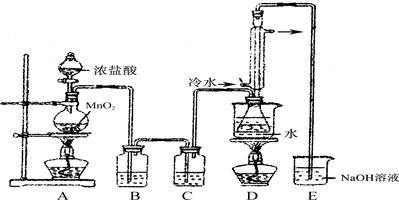
(1) 利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是________(填写以上两种反应原理的数字序号)。
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是________。
(3)D装置中冷凝管的作用是________________;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是________。
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为____________________。
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和________。
(6)上图尾部装置不够完善,存在的问题是____________。