氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:
CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
| A.CO为氧化产物,H2为还原产物 | B.CaCN2中含有非极性键 |
| C.HCN既是氧化剂又是还原剂 | D.每消耗10g CaCO3生成2.24L CO2 |
下列叙述正确的是( )
| A.取淀粉和稀硫酸共热后的溶液,加入新制银氨溶液共热,没有银镜产生,证明淀粉尚未水解成葡萄糖 |
B.结构式为: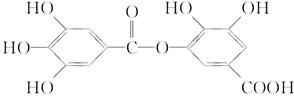 的有机物,可以在稀硫酸催化下发生水解反应,但水解产物只有一种 的有机物,可以在稀硫酸催化下发生水解反应,但水解产物只有一种 |
| C.油脂的水解反应又叫皂化反应 |
| D.在苯环上有1个—OH,1个式量为43的烃基,属于酚类的同分异构体有3种 |
分子式为C4H9O2N的有机物,属于氨基酸的同分异构体的有( )
| A.3种 | B.4种 | C.5种 | D.6种 |
下列反应中不属于酯化反应的是( )
A.CH3CH2OH+HO—NO2 CH3CH2ONO2+H2O
CH3CH2ONO2+H2O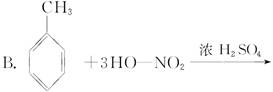
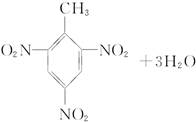
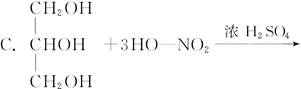
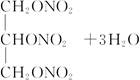
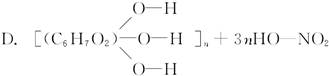
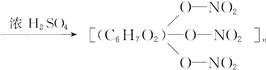 +3nH2O
+3nH2O
下列物质中,不属于酯类的是( )
①酚醛树脂②胶棉③蛋白质④醋酸纤维⑤硬脂酸钠⑥牛油
| A.②④⑥ | B.①③⑤ | C.②④ | D.④⑥ |
为了保护地表的水质,防止河水富营养化,我国对洗衣粉的成分加以限制,其中限制使用的是( )
| A.三聚磷酸钠 |
| B.蛋白酶 |
| C.十二烷基苯磺酸钠 |
| D.硅酸钠 |