固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3△2KNO2+O2↑
II.2Cu(NO3) 2△2CuO+4NO2↑+O2↑
III.2AgNO3△2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6。 (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为 。
②若该固体是混合物,则该混合物的可能组成为 。
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):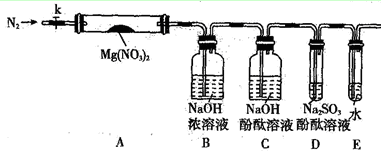
【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
……
① 步骤a的目的是 ;
② 依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为:
_______ 。
③ 若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为 ,用离子方程式表示出现该现象的原因:_____________________ 。
④ 从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?
。
某化学课外活动小组欲制取纯碱Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:A大理石;B盐酸;C氢氧化钠溶液;D澄清石灰水。
三名同学设计的制备方案的反应流程分别如下: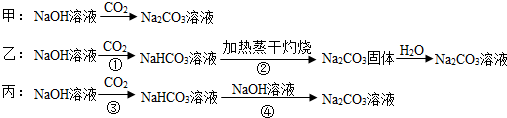
(1)请指出甲、乙两方案的主要缺点:
甲方案_______________________;
乙方案_______________________;
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有______________________;
(3)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3.乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学能否达到实验目的? ______________(填“能”或“不能”)若能,请说明其计算所需的数据;若不能,请简要说明理由______________。
三氯化碘(ICl3,I的化合价为+3价)在药物合成中用途广泛,其熔点:33℃,沸点:73℃,实验室可用如图装置制取ICl3。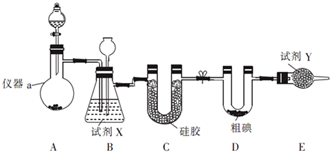
(1)制备氯气选用的药品为漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为:____________________________;
试剂X为________________、Y为______________;
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象____________________________;
(3)某同学欲测定ICl3样品中ICl3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI═2I2+3KCl(样品中杂质不反应).将所得溶液配置成100mL待测液.取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32-═2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为____________________________;重复滴定,实验数据记录如下:
| 滴定次数 |
待测液体积/mL |
Na2S2O3标准液体积/mL |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
| 第三次 |
25.00 |
4.20 |
26.70 |
该样品中ICl3的质量分数为_______________(ICl3相对分子质量为233.5)
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下: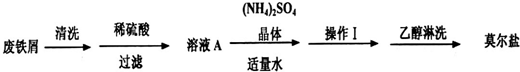
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_________;
(2)浓度均为0.10mol•L-1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者______后者.(填“大于”、“小于”或“等于”或“无法判断”)
(3)0.10mol•L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(4)常温下,若0.10mol•L-1(NH4)2SO4溶液的pH=5,求算NH3•H2O的电离平衡常数Kb≈________;
实验室中欲配制225mL6 mol•L-1的H2SO4溶液,现有足量的18mol•L-1的浓硫酸。现有三种规格容量瓶:100mL、250 mL、500 mL,试回答:
(1)此时最少需要________ mL 浓H2SO4.
(2)可供选择的仪器除容量瓶外,还有 ①玻璃棒②烧瓶③烧杯④量筒⑤药匙 ⑥托盘天平.
上述仪器中,在配制6mol/L 的H2SO4时用不到的仪器是(填代号)________,缺少的仪器是________,你选择的容量瓶的规格是________ mL。使用容量瓶(已经洗涤干净)时的第一步操作是________;
(3)用量筒量取浓硫酸后,应如何混合稀释浓硫酸________;
(4)在配制过程中,下列操作中错误________,能导致结果偏低的操作是________,(填代号,其他操作都正确)。
| A.洗涤量取浓H2SO4后的量筒2-3次,并将洗涤液转移到容量瓶中 |
| B.先将浓H2SO4沿着烧杯壁慢慢到入烧杯中,再向烧杯中加入蒸馏水来稀释 |
| C.未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 |
| D.定容时,加蒸馏水超过容量瓶刻度,又用胶头滴管吸出 |
E.转移溶液前,容量瓶中含有少量蒸馏水
F.定容摇匀后,发现液面低于刻度,又用胶头滴管加蒸馏水至刻度
【加试题】乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下: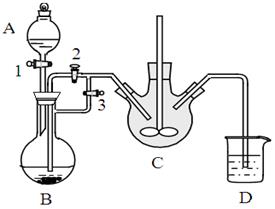
回答下列问题:
(1)NH4HCO3盛放在装置 中(填字母),该装置中涉及的主要反应的离子方程式 。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是 。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是 。