六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主成分为SrSO4)为原料制备,生产流程如下:
(1)第①步反应前天青石先研磨粉碎,其目的是________________。
第③步加入适量稀硫酸的目的是______ _。
(2)第①步反应若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式: ________________________________________。
(3)第④步操作依次是蒸发浓缩、冷却结晶、过滤、________、_______。
(4)称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(产品中不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。若滴定过程用去上述浓度的KSCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为________(保留4位有效数字)。
某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
此方案第一步的实验装置如下图所示:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应离子方程式
(2)加入反应物前,如何检查整个装置的气密性
(3)装置B中盛放的试剂是,作用是。
(4)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4, ⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。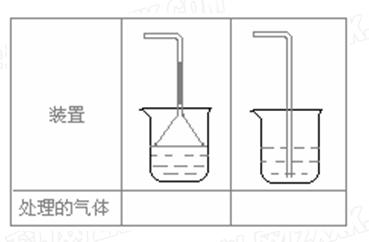
某课外活动小组用如图所示的实验装置探究氯气与氨气之问的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。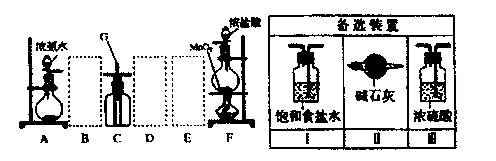
请回答下列问题:
(1)装置F中发生反应的离子方程式是。
(2)装置A中的烧瓶内固体可选用(选填以下选项的代号)。
A.碱石'灰 B.浓硫酸
C.生石灰 D.五氧化二磷
E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的各选装置中选择,并将编号填入下列空格。
B、D、E。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:。
(5)若从装置C的G处逸出的尾气中含有N2和少量Cl2,应如何处理?
某课外活动小组用如图所示的实验装置探究氯气与氨气之问的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。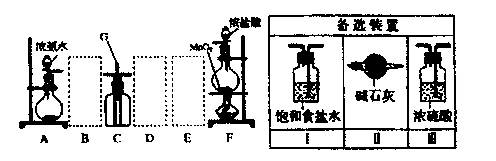
请回答下列问题:
(1)装置F中发生反应的离子方程式是。
(2)装置A中的烧瓶内固体可选用(选填以下选项的代号)。
A.碱石'灰 B.浓硫酸
C.生石灰 D.五氧化二磷
E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的各选装置中选择,并将编号填入下列空格。
B、D、E。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:。
(5)若从装置C的G处逸出的尾气中含有N2和少量Cl2,应如何处理?
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。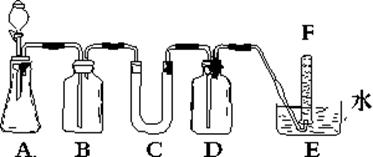
(1)连接好装置后,加入药品前应进行的实验操作是:
(2)A是用石灰石和盐酸制取CO2的装置。写出A中发生反应的离子方程
式:。
(3)在B、C装置中放入的药品依次为:BC:
(4)D中放入氢氧化钠溶液的作用是:
(5)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。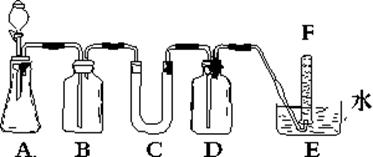
(1)连接好装置后,加入药品前应进行的实验操作是:
(2)A是用石灰石和盐酸制取CO2的装置。写出A中发生反应的离子方程
式:。
(3)在B、C装置中放入的药品依次为:BC:
(4)D中放入氢氧化钠溶液的作用是:
(5)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。