亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2 = 2NaNO2
②2NO2 + Na2O2 = 2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移
的方向和数目 。
(2)B装置的作用是 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂。
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是 (双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(结果保留4位有效数字)
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。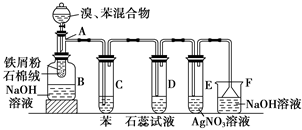
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):
________________________________________________________________________
________________________________________________________________________。
(2)试管C中苯的作用是_________;反应开始后,观察D和E试管,看到的现象为:D中:________;
E中:___________________________ ______。
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是____________________。
(4)在上述整套装置中,具有防倒吸的仪器有________(填字母)。
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是:________________________________。
用A、B、C三种装置都可制取溴苯,请仔细分析三套装置,然后回答下列问题:
(1)写出三个装置中都发生反应的化学方程式 、 ;写出B试管中发生反应的化学方程式 。
(2)装置A、C中长导管的作用是 。
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是 ,
对C应进行的操作是 。
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是 。
(5)B中采用了双球吸收管,其作用是 ;反应后双球管中可能出现的现象是 ;双球管内液体不能太多,原因是 。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是 。
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为____________________,___________________。
(2)①中长导管的作用是________________________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用____________试剂洗涤。洗涤后分离产品应使用的仪器是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是_____________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是___________________________________
b中的试剂是_________________________________
比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)
①____________________________________________
②____________________________________________
某活动小组进行实验室制取硝基苯和溴苯的实验,
(1)写出制取硝基苯的化学方程式______________________
写出制取溴苯的化学方程式______________________
(2)两个实验中除苯外,还需选用哪些药品_______________(可以多选)
| A.溴水 |
| B.液溴 |
| C.浓硝酸 |
| D.稀硝酸 |
E.浓硫酸
F.稀硫酸
G.Fe粉
H.氯化铁
(3)用如图所示装置制取硝基苯时,长玻璃导管的作用是_________。
(4)纯净的溴苯是无色,密度比水大,不溶于水的液体,因溶有溴而呈褐色,可加入_____________溶液洗涤除去其中的溴,写出该溶液除去溴的反应的化学方程式________________________________。
实验室制取硝基苯常用下图装置:
(1)苯的硝化反应是在浓H2SO4和浓HNO3的混合酸中进行的,混酸的添加顺序是先加后加 。
(2)请写出该反应的方程式_______________________________。
(3)被水浴加热的试管口部都要带一长导管,其作用是_____________________________
(4)苯的化学性质是易取代,那么除了苯的硝化反应外,你还能写出其他的取代反应方程式吗?请写出 .