某研究性学习小组在网上收集到如下信息:硫化钠,俗称臭碱,是一种强还原剂,在工业上用途广泛。他们对硫化钠与次氯酸钠的反应进行探究。
【实验】
在次氯酸钠溶液中加入硫化钠溶液,发现溶液始终澄清。
(1)下列有关硫化钠的说法正确的是 。
a.硫化钠溶液不宜久置,应现用现配
b.硫化钠溶液中通入SO2有淡黄色浑浊,可证明SO2有氧化性
c.硫化钠在空气中潮解并不断放出H2S气体,说明酸性:H2CO3>H2S
d.配制硫化钠溶液时加入少量氢氧化钾
e.向硫化钠溶液中滴加稀硝酸有臭鸡蛋气味的气体生成
【提出假设】
(2)反应后的溶液中肯定存在Cl-、SO42-和OH-,为探究溶液中可能还存在的其他阴离子(不考虑离子水解及空气中CO2的影响),该学习小组提出如下假设:
假设1:只还存在S2-
假设2:只还存在ClO-
假设3:
【设计实验方案,验证假设】
(3)请写出实验步骤以及预期现象和结论。
限选实验试剂:1 mol• L-1的CuSO4溶液、1 mol• L-1NaOH溶液、淀粉-KI溶液、紫色石蕊试液、酚酞试液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 |
若 ,则假设 成立。 |
| 步骤:2:另取少许反应后溶液于试管中,滴加 |
若 ,则假设 成立。 若 , 则假设3成立。 |
【思考与交流】
(4)实验时某同学发现所用硫化钠溶液呈黄色,联想到工业盐酸呈黄色的原因,该同学认为所用硫化钠溶液中混有少量FeCl3。你是否同意该同学的的观点 (填“同意”或“不同意”),请简述理由: 。
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④ ⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水___________________;
C.所用过的烧杯、玻璃棒未洗涤___________________;
D.定容时俯视刻度线___________________
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。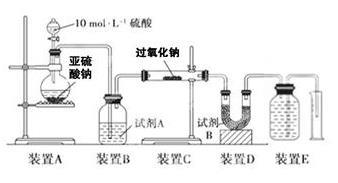
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3: ,证明 。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂A可以选用____________________,试剂B的作用是________________________。
(3)实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________________,完全被氧化:_______________________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用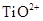 发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。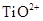 发生水解的离子方程式为_______________________。
发生水解的离子方程式为_______________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示: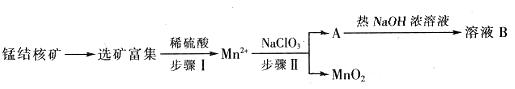
(1)步骤Ⅱ中以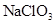 为氧化剂,当生成0.05mol
为氧化剂,当生成0.05mol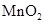 时,消耗
时,消耗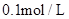 的
的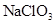 溶液200ml,该反应离子方程式为______________________。
溶液200ml,该反应离子方程式为______________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是_________________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_____________________。
(2)设计实验证明炉渣中含有FeO________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 |
① |
② |
③ |
④ |
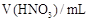 |
50 |
100 |
150 |
200 |
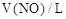 |
1.344 |
2.688 |
3.36 |
3.36 |
则:①m=____________g ②写出实验②发生反应后溶液中Fe2+与Fe3+物质的量之比为:____________。
某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)如果实验室有10mL、15mL、50mL量筒,最好应选用 mL的量筒来量取所需的98%的浓硫酸的体积 mL。
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到仪器A中(仪器A的名称为 )
③将浓硫酸缓缓注入盛有适量仪蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向仪器A中加入蒸馏水,在距离刻度1-2cm时,改用 加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2-3次,洗涤液也注入仪器A中,轻轻摇动仪器A,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为 (填写序号)
(4)下列操作会引起所配溶液浓度偏大的是 (填写字母)
A.量筒用蒸馏水洗涤后未干燥即用来冷却浓硫酸
B.容量瓶用蒸馏水洗净后未干燥即用来配制溶液
C.定容时,观察液面俯视刻度线
E.取用浓硫酸后,将量筒用蒸馏水洗涤并将洗涤液转移容量瓶中
F.摇匀后,液面低于刻度线,没有再加蒸馏水
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下来实验常用到的仪器回答问题:
(1)填写以下仪器的名称:B D E G 。
(2)用四氯化碳提取出溴水中Br2单质的方法叫做: ,将Br2的四氯化碳溶液和水分离开的操作叫做: ,下列是进行该操作的步骤,正确的是顺序是: 。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
(3)已知Br2的沸点是58.5°C,四氯化碳沸点是78°C。将Br2的四氯化碳溶液分离开的方法是 。需要用到的玻璃仪器有(填字母) 。