为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32- (aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因 。
现用如下实验装置测定铜和氧化铜混合物中铜元素的含量。
试回答下列问题:
(1)A中盛装盐酸的仪器名称为。
(2)A中可观察到的现象为。
(3)B装置的作用是。
(4)在给D装置加热前,应该进行的一步操作是,其目的是:
。
(5)已知D装置中铜和氧化铜混合物的质量为10 g,经称量,反应前后E装置的质量分别为100.2 g和102.0 g,原混合物中铜元素的质量分数为(假设各装置中的反应或吸收都是完全的)。
(6)如不加F装置,会使实验结果(填“偏低”或“偏高”)。
实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。

(甲)(乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
| 乙酸 |
1-丁醇 |
乙酸丁酯 |
|
| 熔点(℃) |
16.6 |
-89.5 |
-73.5 |
| 沸点(℃) |
117.9 |
117 |
126.3 |
| 密度(g/cm3) |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
可溶 (9g/100g水) |
微溶 |
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的
理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①___________________________________________________________________,
②___________ ________________________________________________________。
________________________________________________________。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。

A B C D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______
______________________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有。
Ⅰ。一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________(答案可能不唯一)
| A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏; |
| B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶; |
| C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小; |
| D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大; |
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
Ⅱ . 现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。
回答有关问题: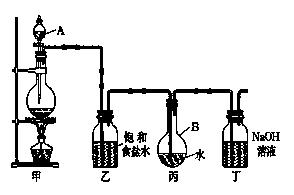
(1)写出有关化学方程式。
装置甲:____________________________________ ;
装置丁:__________________。
(2)证明氯水已饱和的现象是。
(3)制取结束时,装置丙的液体中含有的微粒是(用 微粒符号表示 );
微粒符号表示 );
(4)若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是:。
测定饱和氯水的pH方法是_______________________________________________。
Ⅲ.实验设计:证明NaOH固体在空气中放置部分变质
_______________________________________________________________ _______________________________________________________________________
_______________________________________________________________________
某研究性学习小组探究NO3在不同环境中的氧化性。
(1)实验一:①试管a、b中均加入等浓度等体积的NaNO3溶液和等质量的铜片,加热,无明显现象;②向试管a中加入VmL NaOH溶液,加热,无明显现象;③向试管b中加入VmL稀H2SO4,加热,可观察到的现象是。
实验一的目的是。
(2)实验二:利用图装置探究不同浓度HNO3的氧化性。①已知电流计指针偏转方向足电子移动方向。将铜、铁两极同时插入浓HNO3中,观察到电流计指针指向铜,但迅速反转,指针偏向铁一端,此时铁做极(填“正”或“负”);指针反转的原因是。
②将浓HNO3改为稀HNO3后,观察到电流计指针指向铜,此时正极反应式是
。
兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。
| 序号 |
实验操作 |
实验现象 |
| I |
稀硫酸中加入铜片 |
无明显变化 |
| II |
硝酸钠溶液中加入铜片 |
无明显变化 |
| III |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入铜片 |
有无色气泡;溶液变蓝 |
① 实验I、II的目的是。
②实验III中反应的本质是(用离子方程式表示)。
(2)利用电化学原理实现铜溶于稀硫酸并生成氢气。
① Cu作极。②总反应的离子方程式是。