化合物A~H的转化关系如下图所示,A是一种军用催泪弹的主要成分。已知:
i.A的相对分子质量为161,除含有C、H元素外,它还含有一种卤族元素,分子中只含有一个甲基。
ⅱ.足量的新制 悬浊液与1 mol C反应可生成1 mol
悬浊液与1 mol C反应可生成1 mol  和1
和1  。
。
ⅲ. 和
和 互为同分异构体,
互为同分异构体, 的摩尔质量为
的摩尔质量为 。
。
ⅳ. 和
和 互为同分异构体,二者的核磁磁共振氢谱均只有两种氢环境,
互为同分异构体,二者的核磁磁共振氢谱均只有两种氢环境, 无甲基。
无甲基。
已知:①
②一个碳原子上连有两个碳碳双键的结构 不稳定。
不稳定。
请完成下列问题:
(1) A中官能团的名称 。
(2)①~⑥反应中属于消去反应的是 ;A的结构简式 。
(3)反应④的化学方程式 。
(4)C与新制 反应的方程式 。
反应的方程式 。
(5)一定条件下H能够生成高分子化合物,此反应的化学方程式
。
(6)与E具有相同官能团且含有三个甲基的同分异构体共有 种;写出其中一个的结构简式为 。
(15分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I:4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II:2NO(g)+O2(g)  2NO2(g) △H2(且|△H1| =2|△H2|)
2NO2(g) △H2(且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K |
反应I |
反应II |
已知: K2>K1>K2′>K1′ |
| 298 |
K1 |
K2 |
|
| 398 |
K1′ |
K2′ |
(1)推测反应III是反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=。
②下列说法正确的是。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO) ∶n(O2)∶n(NO2)=2∶1∶2。在其它条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2);恒温恒容容器,φ(NO2)。
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则: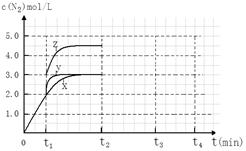
①变为曲线Y改变的条件是。变为曲线Z改变的条件是。
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2- t4内c(N2)的变化曲线。
开发新能源、新材料是实现社会可持续发展的需要。请回答下列问题:
(1)下图是2LiBH4/MgH2体系放氢焓变示意图。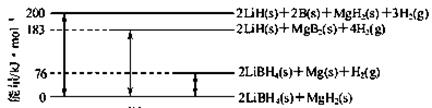
则:Mg(s)+2B(s)=MgB2(s)ΔH=。
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系如图所示。下列说法正确的是(填字母)。
A.25℃时,纯铝与水不反应
B.25℃时,纯LiBH4与水反应产生氢气
C.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。
CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
上述合成甲醇的反应为反应(填“放热”或“吸热”)。平衡常数KA、KB、KC的大小关系为。若达到平衡状态A时容器的体积为10 L,则平衡状态B时容器的体积为L。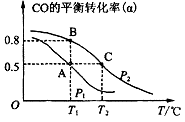
②图中虚线为该反应在使用催化剂条件下,起始H2、CO投料比和CO平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图。
(4)己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚(CH3OCH3)碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是(填字母)。
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(5)LiFePO4与Li1-xFePO4作为磷酸亚铁锂电池电极材料,充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LixC6-xe-═xLi++6C,写出电池放电时反应的化学方程式。
(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示。其中R元素的最外层电子数是次外层电子数的一半。
| X |
Y |
Z |
M |
| R |
W |
请回答下列问题:
(1)画出R的原子结构示意图。
(2)比较Z、W的简单氢化物沸点高低并说明原因。
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%。则化合物甲的化学式为。
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
(4)FeSO4溶液显弱酸性的原因是(用离子方程式表示)。
(5)加入浓硫酸调节pH的作用是:①;②。
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:
Sn2++2Hg2++8Cl- = Hg2Cl2↓+SnCl62-
Cr2O72-+14H++6Fe2+ = 2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是。
②称取聚铁质量为10.00 g配成100.0 mL溶液,取出20.00 mL,经上述方法处理后,用0.1000 mol·L-1 K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80 mL。则聚铁中铁元素的质量分数为%。
【化学—选修3:物质结构与性质】中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物。回答下列问题:
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是(用元素符号表示)。
(2)叠氮酸(HN3)是一种弱酸,可电离出H+和N3一。
①N3一的立体构型是形:与N3一互为等电子体的一种分子是(填分子式)。
②叠氮化物能与Co 3十形成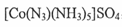 ,该配合物中心离子的配位数为;
,该配合物中心离子的配位数为;
基态钻原子的价层电子排布式为
(3)磷能形成多种含氧酸,某资料认为次磷酸的结构如图。按此结构,P原子采用的杂化方式为,次磷酸分子中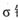 键与
键与 键数目之比为,次磷酸属于酸(填“强”或“弱,’),lmol次磷酸最多能与mo1NaOH发生中和反应。
键数目之比为,次磷酸属于酸(填“强”或“弱,’),lmol次磷酸最多能与mo1NaOH发生中和反应。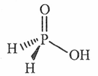
(4)己知钾的一种化合物KIC12受热可分解,倾向于生成晶格能更大的物质。则下列化学反应更易发生的是
(5)钾在氧气中燃烧时得到多种氧化物,其中一种是面心立方结构,晶胞结构如下图所示。若该氧化物的密度是 ,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
【化学—选修2:化学与技术】铁、锰、锌、铜、硼等是农作物生长必需的微量元素。某课题组研究利用废弃锌锰电池和工业废料硼镁泥生产复合微量元素肥料〔简称复合微肥)。流程如下所示: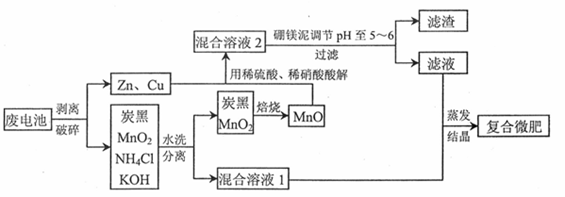
己知:
①硼镁泥中含MgO, Na2B4O7, MnO, Fe2O3, SiO2, CaO等化合物
②MnO2不溶于硫酸和硝酸,MnO可溶于酸
回答下列问题:
(1)上述方法生产的复合微肥除了含有农作物生长必需的多种微量元素外,还含有必需的大量元素氮和(填元素名称)。
(2)焙烧时反应的化学方程式为,焙烧的目的是
(3)酸解过程中气体产物可循环利用的是;酸解后的溶液加入硼镁泥调节溶液pH时,有H3BO3沉淀生成,该反应的离子方程式为;
已知: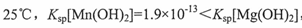 ,若溶液的pH调节到6,计算说明是否会析出Mn(OH)2, Mg(OH)2沉淀.
,若溶液的pH调节到6,计算说明是否会析出Mn(OH)2, Mg(OH)2沉淀.
(4)产品中锰元素含量的测定:称取ag产品,溶于适量蒸馏水中,向所得溶液中加入足量NaClO溶液,发生反应 ,过滤、洗涤、干燥后称得MnO2质量为b g,则产品中锰元素的质量分数为。
,过滤、洗涤、干燥后称得MnO2质量为b g,则产品中锰元素的质量分数为。
(5)己知玻璃可微量溶于水。实际生产中,常选用废玻璃、粉煤灰、炼钢炉渣和矿石等为原料高温烧制,将熔融物冷水淬冷成块,再磨成细粉即得玻璃微肥。玻璃微肥具有的优点是(任答一条即可)。