开发新能源、新材料是实现社会可持续发展的需要。请回答下列问题:
(1)下图是2LiBH4/MgH2体系放氢焓变示意图。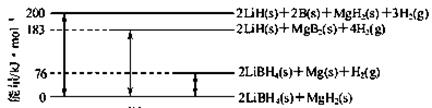
则:Mg(s)+2B(s)=MgB2(s) ΔH= 。
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系如图所示。下列说法正确的是 (填字母)。
A.25℃时,纯铝与水不反应
B.25℃时,纯LiBH4与水反应产生氢气
C.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。
CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
上述合成甲醇的反应为 反应(填“放热”或“吸热”)。平衡常数KA、KB、KC的大小关系为 。若达到平衡状态A时容器的体积为10 L,则平衡状态B时容器的体积为 L。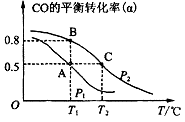
②图中虚线为该反应在使用催化剂条件下,起始H2、CO投料比和CO平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图。
(4)己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚(CH3OCH3)碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)。
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(5)LiFePO4与Li1-xFePO4作为磷酸亚铁锂电池电极材料,充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LixC6-xe-═xLi++6C,写出电池放电时反应的化学方程式 。
A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量不变,完全燃烧后所产生的CO2的质量就不变。
(1)试写出两组符合上述情况的烃的结构简式:
________________和________________;
________________和________________。(与第一组的物质类别不同)
(2)A、B应满足的条件是_____________________________________________。
甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:
Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为:。
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式____。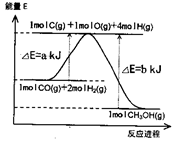
实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| 10min |
20min |
30min |
40min |
50min |
60min |
|
| 3000C |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 5000C |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________。
(3)5000C平衡常数K=___________。
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是。
【设计、完成实验】
(1)称取g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和。
②下列操作会使所配溶液浓度偏低的是(填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间 (s) |
|||
| 0.10mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
18 |
|
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5mL 0.10mol/L K2SO4溶液 |
18 |
则x =,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:。上述实验中KMnO4溶液的物质的量浓度为。
[化拳——化学与技术](15分)
粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。 一种利用粉煤灰制取氧化铝的工艺流程如下: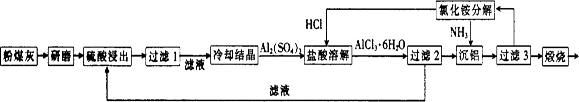
(1)粉煤灰研磨的目的是。
(2)第1次过滤时滤渣的主要成分有(填化学式,下同)和,第3次过滤时滤渣的成分是。
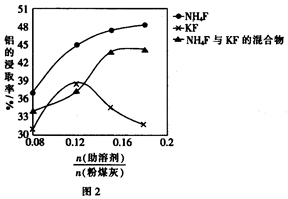
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例)。
相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例)。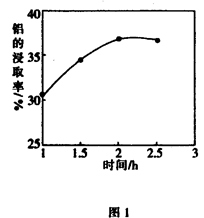
(4)流程中循环使用的物质有和。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13·6H20,该过程能够发生的原因是。
(6)用粉煤灰制取含铝化合物的主要意义是。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
(1)酸浸时反应的化学方程式为;滤渣Ⅰ的主要成分为(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因
是(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”、“减小”或“不变”)。