乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。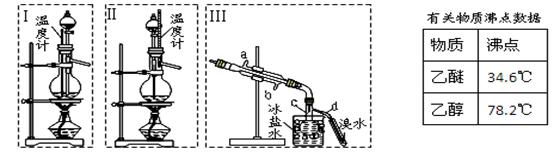
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择 (选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
。
2.Ⅲ中水冷凝管的进水口是 (选答“a”或“b”)。冰盐水的作用是 。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设
计了以下几种装置与导管d连接,你认为合理的是(选填编号) 。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中有气体生成化学方程式(写两个方程式) ; 。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案: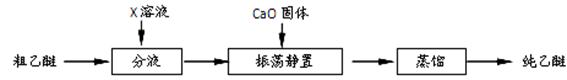
(1)分液步骤除去产品中的酸性杂质,则X可以是 。
(2)蒸馏操作可除去的杂质是 。
实验室用如图所示装置分离CO2和CO气体并干燥。请完成(1)—(2)两个小题。
图3-9
(1)图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹c、d分别接两球胆。现装置内的空气已排尽。为使实验成功,甲、乙、丙分别盛放的溶液是()
A.NaHCO3饱和溶液、12 mol·L-1盐酸、18.4 mol·L-1 H2SO4
B.NaOH饱和溶液、2 mol·L-1 H2SO4、18.4 mol·L-1 H2SO4
C.Na2CO3饱和溶液、2 mol·L-1 H2SO4、NaOH饱和溶液
D.18.4 mol·L-1 H2SO4、NaOH饱和溶液、18.4 mol·L-1 H2SO4
(2)①打开a ②打开b ③打开c ④打开d,为了使气体分离,下列打开止水夹(或活塞)的顺序正确的是(关闭的步骤省略,只要打开的步骤)()
A.①④②③ B.①②③④
C.②①③④ D.③④①②
(1)等物质的量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是______。
(2)等质量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是__________。
(3)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的物质的量之比是__________。
(4)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的质量之比是_______________。
已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c( )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c( )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为__________(填序号)。
(2)若四种离子的关系符合③,则溶质为__________;若四种离子的关系符合④,则溶质为__________ 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是__________(填图象符号)。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
(5)如右图所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是___________,正极反应式是______________。
(9分)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热_________装置,原因是__________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是______________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是_________________。
(4)若保留上图中黑色粗线框内的装置,但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。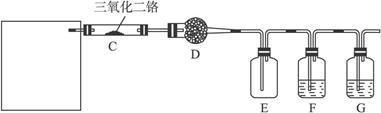
(8分)有甲、乙两位同学想利用下列装置及化学试剂,对实验室制取并收集氨气的实验进行改进。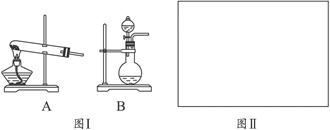
化学试剂:①NH4Cl固体 ②浓氨水 ③固体NaOH
(1)甲同学想方便快速制取少量氨气,应选择的装置是_________ (填序号)。
选用试剂是_________(填序号),选用上述试剂制氨气的理由是__________________。
(2)乙同学建议,把教材中实验室制取氨气的收集装置由大试管改为集气瓶且瓶口向上收集氨气,并确保不污染环境,请你根据其设想完成问题:
若用排气法收集氨气,请在图Ⅱ的方框内画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。