【化学——选修3:物质结构与性质】
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。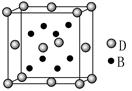
请回答下列问题:
(1)C-的电子排布式为______________;E元素原子的价电子排布式为________。
(2)元素B与氮元素可以形成化合物NB3,其中N—B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。
(3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是 。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为 。
(5)含有D元素的化合物焰色反应为______色,焰色反应的原理是 。
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g) TiCl4(l)+O2 (g)ΔH=+151 kJ·mol-1
TiCl4(l)+O2 (g)ΔH=+151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g)ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g)ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
以下框图是无机物A ~ N的转化关系(部分产物及反应条件未列出)。已知E、F、G、J为单质,且E、F为金属单质;物质M、M′由相同元素组成,M′是黄色固体,M′常用于工业上制取A;D、I也由相同元素组成,I为黑色有磁性的晶体;B是有臭鸡蛋气味的气体,C是有刺激性气味的气体。请根据以上框图填写以下空白: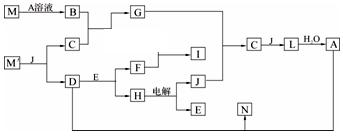
(1)B的电子式是______________;
B分子属_________分子(填“极性”或“非极性”);
(2)B与C气体间反应的实验现象是
;
将E或F金属片放入A的浓溶液中,现象是___________ ____________________;
(3)用石墨作电极,以碱性锌锰干电池电解H,己知干电池总反应为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,阳极的电极反应式是 。当生成J的气体体积为11.2L(标准状况)时,干电池消耗的负极材料质量为 g;
(4)C与N溶液反应的离子方程式是 ;
I溶于稀硝酸的离子反应方程式为 ;
(5)过量F溶于HI的溶液,取所得溶液再与过量稀HNO3反应的离子反应方程式为:
;
(6)在化工生产中,由M′制A,现有100T质量分数为80℅的M′参加反应,若几步反应总的转化率为80℅,则可生成98℅的A溶液 T(结果保留一位小数)。
四川盛产柠檬,这种果实中富含柠檬酸。柠檬酸有温和爽快的酸味,多用于各种饮料的生产原料,在有机酸的市场中占有率为70%以上。
(1)已知柠檬酸仅由C、H、O三种元素组成。其分子量不超过200,其中含氧元素58.3%。通过计算并写出柠檬酸的分子式_______________。
(2)已知柠檬酸不能被CuO氧化,与氯气反应后的一氯代物只有一种,1 mol 的柠檬酸分别与钠和碳酸氢钠反应生成气体为2 mol 和3 mol,则柠檬酸的结构式为(写入方框内):
(3)柠檬酸和乙醇与浓硫酸共热能发生酯化反应,可生成 种酯类化合物。
(4)柠檬酸可以烃A为主要原料加以合成。已知:
i.烃中既有双键又有三键时,一定条件下三键先发生反应;
ii.
烃A合成柠檬酸的一种合成途径如下,其中1molC与2molHBr反应生成D,D中只含3种不同的氢原子:根据以上信息回答下列问题:
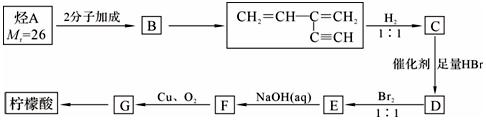

①G中含氧官能团的名称 ;②E→F的反应类型___ _____;
③B的结构简式______________;
④写出指定反应的化学方程式:
G+新制Cu(OH)2: ;
F→G:________ ___ ______ ;
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g) + 3B(g)  2C(g)
2C(g)
(1)向M、N中,各通入1mol A和3mol B。初始M、N容积相同,并保持温度不变。则到达平衡时A的转化率α(A)Mα(A)N A的体积分数x(A)Mx(A)N
(2))向M、N中,各通入x molA和y molB,初始M、N容积相同,并保持温度不变。若要平衡时保持A气体在M、N两容器中的体积分数相等,则起始通入容器中的A的物质的量xmol与B的物质的量ymol之间必须满足的关系式为
(3)若在某件下,反应A(g) + 3B(g)  2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为;保持温度和压强不变,向此容器内通入0.36mol A,平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为;保持温度和压强不变,向此容器内通入0.36mol A,平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
。
(12分)
本题共有3个小题,回答有关问题:
(1)检验牙膏中含有甘油的试剂是,实验现象;有关反应的化学方程式。
(2)在两烧杯中盛有甲、乙两种不同的稀溶液,用铁丝做电化腐蚀实验。实验进行一段时间后,A试管中液面高于烧杯中液面,B试管中液面低于烧杯中液面,试比较pH值大小:
甲乙(填“<”、“>”或“=”),并写出A中铁丝发生腐蚀时的电极反应式:负极,正极。
(3)已知某溶液中只存在 、H+、
、H+、 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
I:
II:
III: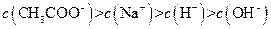
IV:
①若溶液中只溶解了一种溶质,则该溶质是,上述四种离子浓度的大小顺序
为(填编号)。
②若上述关系中III是正确的,则溶液中溶质为
③若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为
 (填“<”、“>”或“=”),混合前
(填“<”、“>”或“=”),混合前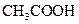 溶液中的
溶液中的
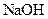 溶液中的
溶液中的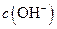 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。