对某芳香烃A分析结果如下:质谱图显示其最大质荷比为120,红外光谱显示其有两个甲基,核磁共振氢谱显示有五种峰且其面积比为1:2:2:1:6,A在有机合成中能发生如下转化: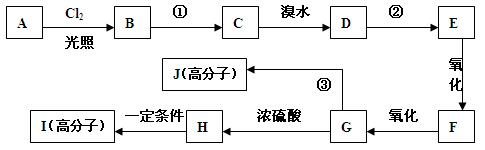
(已知:烃基发生取代反应的活性次序为 CH > CH2 > CH3 即叔氢>仲氢>伯氢)
回答以下问题:
(1)写出A的结构简式 ;
(2) 反应①和②相同的反应试剂和条件为 ;
(3)F分子中的含氧官能团名称是 ;
(4)反应③的化学方程式为: ;
(5)写出满足下列条件的H分子的所有同分异构体的结构简式:
①含有苯环 ②1 mol有机物发生银镜反应生成4 mol Ag ③苯环上的一溴代物有两种
;
(6)与H具有相同官能团的H的同分异构体有四种,其中一种分子K还存在顺反异构
体,试写出K的结构简式: 。
Al(OH)3的电离方程式可表示为:H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,请根要求完成下列问题: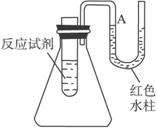
(1)有关反应的离子方程式是________________________________________________,试管中看到的现象是____________________________________。
(2)S形导管中液面A__________(填“上升”或“下降”),原因是_______________________;说明此反应是___________________(填“放热”或“吸热”)反应。
将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键Si—OSi—ClH—HH—ClSi—SiSi—C
键能/kJ•mol—1460360436431176347
请回答下列问题:
⑴比较下列两组物质的熔点高低(填>或<)
SiC______Si;SiCl4______SiO2
⑵图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g);该反应的反应热△H=___________KJ/mol