酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。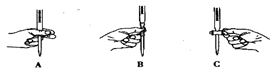
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。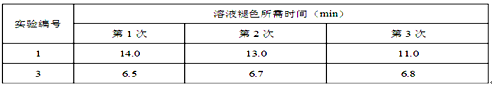
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。 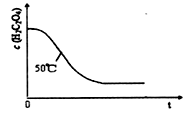
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案 ______________________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为 。
下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为杂化, 键与
键与 键的个数比为。
键的个数比为。
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为。其中⑥元素核外电子的电子排布图为。
(3)③元素形成的最高价氧化物所形成的晶胞边长为acm,则其晶胞密度为;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为。
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为,形成的化学键为。
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序)。
氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是.
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为。
II.工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称)。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu(填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极:;阴极:。
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) |
C(NH3) |
C(O2) |
C(NO) |
C(H2O) |
| 甲 |
1 |
2 |
0 |
0 |
| 乙 |
4 |
8 |
0 |
0 |
| 丙 |
0.2 |
x |
y |
z |
①恒温恒容下,平衡时NH3的转化率甲乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=,y=,z= .
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g) N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_a2。
A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:。反应过程中,氧化剂和还原剂物质的量之比为。
(2)若反应中生成0.2mol HNO3,转移的电子数目为。
微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石.矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:。
(2)从硫酸铜溶液中提取铜,简便而经济的方法是;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe H2
H2 Cu ②CuO
Cu ②CuO CuSO4
CuSO4 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
(5)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为____________.电解粗铜制取精铜,电解时,阳极材料是__________,电解液中必须含有的阳离子是________.
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是。
化学方程式能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握一项基本技能。请按照要求完成下列方程式。
Ⅰ.生活中很多现象和原理都可以用化学反应来解释:写出 泡沫灭火器反应原理 的离子方程式:
________________________________________________________________________
Ⅱ.某一反应体系有反应物和生成物共六种物质:N2O.FeSO4.Fe(NO3)3.HNO3.Fe2(SO4)3和H2O。写出该反应的化学方程式:
________________________________________________________________________
Ⅲ.有一些反应,表面上似乎违背了反应的基本原理,事实上他们是完全符合反应基本原理的。请完成下列反应:
① 写出 两种弱酸溶液混合反应后,溶液的酸性减弱 的化学方程式
________________________________________________________________________
② 写出 一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸 的离子反应方程式