(16分) 硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料 ①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl△2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
设计实验 某同学设计如图所示装置制备三氯化硼:
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,而且不需要加热,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式: _____。
(2)E装置的作用是 。如果拆去B装置,可能的后果是 。
(3)实验中可以用一个盛装 (填试剂名称)的干燥管代替F和G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式: ;实验室保存三氯化硼的注意事项是 。
(5)为了顺利完成实验,正确的操作是 (填序号).
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓 (填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
滴定实验是化学学科中重要的定量实验。
请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)→c→→→d→→
②在G操作中如何确定终点?。
③在G操作中,眼睛应观察(填选项字母)
A.锥形瓶中溶液颜色变化B.滴定管中溶液液面的变化
(2)下列操作造成测定结果偏高的是(填选项字母)
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 |
待测液体积(mL) |
标准KMnO4溶液体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
3.00 |
23.00 |
| 第三次 |
25.00 |
4.00 |
24.10 |
(1)滴定时,KMnO4溶液应装在(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是。
(2)该草酸溶液的物质的量浓度为_____________。
(18分)一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷: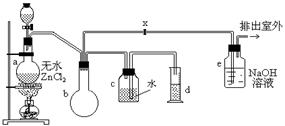
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式,其反应类型属于反应;
(2)装置b的作用是;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~浓盐
酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是;
(7)实验结束后,d中收集到的液体中含有。
(每空2分,共24分)下图为实验室某盐酸试剂瓶标签上的有关数据,
试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为mol•L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol•L-1的稀盐酸。
①容量瓶上需标有以下五项中的
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②将下列操作填写完整,并排列其正确的操作顺序(用字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡。
B.用量筒准确量取浓盐酸mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀。
C.将已冷却的盐酸沿玻璃杯注入中。
D.将容量瓶盖紧,颠倒摇匀。
E.改用加水,使溶液凹液面恰好与刻度相切。
F.继续往容量瓶内小心加水,直到液面接近刻度处。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填“偏大”、“偏小”、“无影响”)。
Ⅰ用量筒量取浓盐酸时俯视观察凹液面
Ⅱ定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅲ定容时仰视刻度线
Ⅳ溶液注入容量瓶前没有冷却至室温
(2013)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: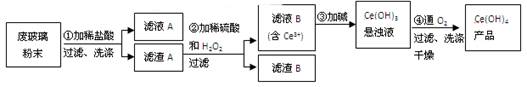
(1)洗涤滤渣A的目的是为了除去 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。。
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到了Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该产品中Ce(OH)4的质量分数为 。
硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
【实验结论】探究① 探究② 。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质 。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由: 。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是 。