我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下: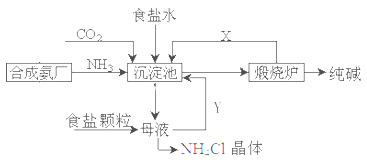
(1)完成有关反应的化学方程式
①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。
(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
(1)请写出烷烃CnH2n+2(n≥1)在足量的氧气中充分燃烧的化学方程式:__________。
有①甲烷,②乙烷,③丙烷,④丁烷4种烷烃,试回答(2)~(4)题(填序号):
(2)相同状况下,等体积的上述气态烃充分燃烧,消耗O2的量最多的是________。
(3)等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是________。
(4)10 mL某气态烃,在50 mL O2中充分燃烧,得到液态水,以及体积为35 mL的混合气体(所有气体体积均在同温、同压下测定)。该气态烃是________。
已知某烷烃分子中电子数为42。
(1)该烷烃的分子式为_______________________。
(2)写出该烷烃分子的所有同分异构体的结构简式_____________。
(3)上述同分异构体中,在相同条件下沸点最低的是_____________。(写结构简式)
管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们燃烧的反应如下:2CO+O2 2CO2,2H2+O2
2CO2,2H2+O2 2H2O,CH4+2O2
2H2O,CH4+2O2 CO2+2H2O,根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是________;因此燃烧管道煤气的灶具如需改用烧天然气,灶具改进的方法是________进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是_____________。
CO2+2H2O,根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是________;因此燃烧管道煤气的灶具如需改用烧天然气,灶具改进的方法是________进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是_____________。
管道煤气中含有的烃类除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质如下表:
| 乙烷 |
丙烷 |
丁烷 |
|
| 沸点(℃) |
-88.6 |
-42.1 |
0.5 |
试根据以上某个关键数据解释冬天有时管道煤气火焰很小,并且呈断续状态的原因是_____________。
某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意,回答下列问题:
(1)CH4与Cl2发生反应的条件是________;若用日光直射,可能会引起_______________________________。
(2)实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,__________,____________________等。
(3)实验中生成的油状液滴的化学式为________,其中________是工业上重要的溶剂。
(4)用饱和食盐水而不用水的原因是____________________________________
如图,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。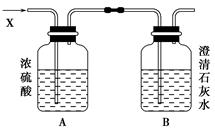
试回答下列问题:
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是________________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是________________。
(3)若A、B两个洗气瓶的质量都增加,试推测X可能有几种组合,填写下表。(有多少种写多少种,可不必填满)
| 组合 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| X |